
下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为
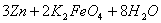

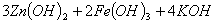
下列叙述不正确的是
A.充电时阳极反应为: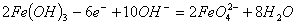
B.放电时负极反应为: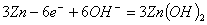
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1) 写出下列元素的名称:C E
(2) 写出A、B、C形成的化合物M的电子式
(3) 实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为
(4) D单质与M的水溶液反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既属于氧化还原反应,又是吸热反应的是
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.酒精在空气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人。已知合成氨的反应为N2(g)+3H2(g) 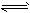 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
Ⅰ.在体积为2L的恒温、恒容密闭容器甲中,起始时投入2 mol N2、3 mol H2,经过
10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
Ⅱ.在容器乙中,起始时投入3 mol N2、n mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2 mol。此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同。
(1)容器甲10 s内用H2表示的平均反应速率v(H2)=______________________,达平衡时N2的转化率=________________。
(2)甲容器中反应的逆反应速率随时间变化的关系如右下图。t2时改变了某一种条件,改变的条件可能是_____________________、____________________(填写两项)。
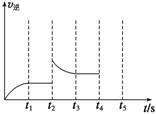 (3)下列哪些情况不能表明容器乙已达平衡状态__________(填字母)。
(3)下列哪些情况不能表明容器乙已达平衡状态__________(填字母)。
A.容器乙中的气体密度不再变化 B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1 mol N≡N键同时断裂6 mol N—H键
D.容器乙中气体的平均相对分子质量不随时间而变化
(4) n=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140.5 kJ·mol-1
C(s,石墨)+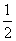 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
A.+80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.-80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中活化分子百分数的是 ( )
2SO3,改变下列条件,可以提高反应物中活化分子百分数的是 ( )
A、增大压强 B、降低温度
C、加入催化剂 D、减小反应物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g) 
 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(A)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为75% D.反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
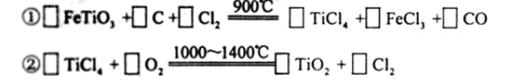
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com