
| A、-2 | B、+2 | C、+4 | D、+6 |
科目:高中化学 来源: 题型:
| A、钾的密度比钠的小 |
| B、钾原子的电子层比钠原子多一层 |
| C、钾与水反应比钠与水反应更剧烈 |
| D、加热时,钾比钠更易汽化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A、不能使酸性KMnO4溶液褪色 |
| B、不能使溴水褪色 |
| C、在加热和催化剂作用下,最多能和4mol H2反应 |
| D、一定条件下,能和NaOH醇溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol聚乙烯含有的原子数目为6NA |
| B、标准状况下,11.2L二氯甲烷所含分子数为0.5NA |
| C、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| D、1mol甲基含10NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
| C、已知NaClO+SO2+H2O→HClO+Na2SO3,说明给出质子能力:HSO3->HClO | ||||
D、已知CaCO3+SiO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,两饱和溶液中c(Ca2+):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
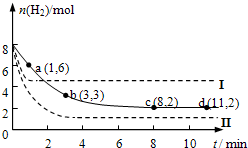 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q(Q>0)某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q(Q>0)某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com