
 PM2.5������ο������Ⱦ������ȼú������أ�ȼú��ͬʱ�ŷŴ�����CO2��SO2��NOx
PM2.5������ο������Ⱦ������ȼú������أ�ȼú��ͬʱ�ŷŴ�����CO2��SO2��NOx
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
| ||
| �� |
| 0.09mol |
| 5L��0.5min |
| 10 -3��10 -3 |
| 0.1-10 -3 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢� | B���ۢ� |
| C���٢ۢ� | D���ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
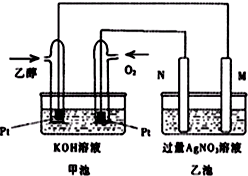 ��ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺
��ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na2O2�pCaO�pK2O���Ǽ��������� |
| B��BaSO4�pNaCl�pKNO3��Һ���ǵ���� |
| C������p�ռ�p��ʯ�Ҷ��Ǽ� |
| D��ϡ�����p�����p������Һ���ǽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ʵ���ư��� |
B�� ��ȥCl2�е�HCl |
C�� Na2CO3��NaHCO3���ȶ��ԱȽ� |
D�� ����Ʒ�����п |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
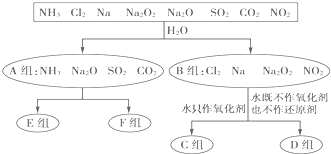
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ����������β������װ�� |
B�� ������̼����Ȫʵ�� |
C�� �Ʊ����ռ����� |
D�� �ռ�NO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ŨHCl |
| B������ʯ�� |
| C�����ռ�� |
| D����NaCl��Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com