
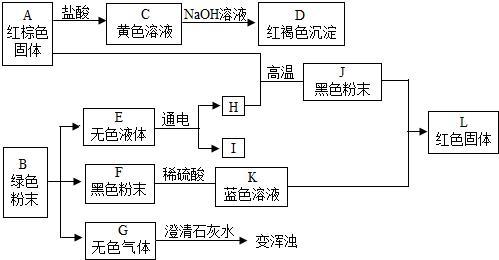
分析 红棕色固体A与盐酸反应黄色溶液C,C与氢氧化钠反应生成氢氧化铁红褐色沉淀D,所以A为氧化铁,C为氯化铁,D为氢氧化铁;黑色固体F与硫酸反应生成蓝色溶液K,所以K为硫酸铜,F为氧化铜,红色固体L为铜,氧化铁与H反应生成黑色固体J.所以J为铁,E通电会生成H和I,H与氧化铁反应生成铁,所以E是水,L为氢气,I是氧气;B受热会生成水、氧化铜和气体G,气体G又会使澄清石灰水变浑浊,所以E是二氧化碳,A是碱式碳酸铜.
解答 解:(1)红棕色固体A与盐酸反应黄色溶液C,C与氢氧化钠反应生成氢氧化铁红褐色沉淀D,所以A为氧化铁,C为氯化铁,D为氢氧化铁;黑色固体F与硫酸反应生成蓝色溶液K,所以K为硫酸铜,F为氧化铜,红色固体L为铜,氧化铁与H反应生成黑色固体J.所以J为铁,E通电会生成H和I,H与氧化铁反应生成铁,所以E是水,L为氢气,I是氧气;B受热会生成水、氧化铜和气体G,气体G又会使澄清石灰水变浑浊,所以E是二氧化碳,A是碱式碳酸铜,
故答案为:Fe2O3;Cu2(OH)2CO3;:CO2;
(2)C→D是氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,化学方程式为FeCl3+3NaOH═3NaCl+Fe(OH)3↓,
E→H+I是水电解生成氢气和氧气,化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
J+K→L是铁置换出硫酸铜中的铜,化学方程式为Fe+CuSO4═Cu+FeSO4,
故答案为:FeCl3+3NaOH═3NaCl+Fe(OH)3↓;2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;Fe+CuSO4═Cu+FeSO4;
(3)铁的化学性质比较活泼,在潮湿空气中易生锈,在博物馆里很少见到由铁制造的完好文物,故答案为:铁的化学性质比较活泼,在潮湿的空气中容易生锈.
点评 本题考查无机物推断,充分利用物质的颜色为突破口进行推断,需要学生熟练掌握元素化合物性质,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的溶液中滴入稀盐酸.放出气体的快慢Na2C03<NaC03 | |
| B. | 热稳定性Na2C03<NaHC03 | |
| C. | 常温时水溶性Na2C03<NaHC03 | |
| D. | 相对分子质量Na2C03<NaHC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com