
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】由两种短周期元素组成的化合物XY3,若两种元素的原子序数分别为a和b,则a和b的关系正确的是
①a=b+4;②a+b=8;③a+b=30;④a=b+8
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用一种微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是
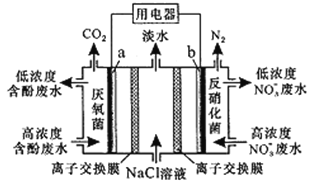
A. a为正极,发生氧化反应
B. b极上的电极反应为:2NO3-+12H+-10e-=N2↑+6H2O
C. 中间室的Cl-向左室移动
D. 左室消耗苯酚(C6H5OH)9.4g时,用电器流过2.4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)9.8克SO42﹣的物质的量为 , 质子数为个(用NA表示)
(2)在3S+6KOH═2K2S+K2SO3+3H2O的反应中,氧化剂还原剂 , 氧化剂与还原剂的质量之比为 .
(3)在标准状况下,33.6L的NH3将其溶解于水配成1L的溶液,则溶液的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO32-。回答下列问题:
(1)阳极泥预处理时发生反应: Cu2Te+O2→CuO+TeO2,Cu2Te中Te的化合价为_____,该反应中氧化剂与还原剂的物质的量之比为_________。
(2)“过滤I”所得滤液中,阴离子主要有_______,要从滤渣1中分离出Au,可以向滤渣中加入的试剂是_________。
(3)步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为________,防止酸度局部过大的操作是____________。
(4)步骤④发生反应的离子方程式是____________。
(5)高纯碲的制备采用电解精炼法。将上述流程得到的粗碲溶于NaOH溶液配成电解液,用适当的电极进行电解,阳极产生的气体是____,阴极上的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,Q2>Q1的是(双选)( )
A. 2H2(g)+O2(g)===2H2O(g) ΔH=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH=-Q2
B. S(g)+O2(g)===SO2(g) ΔH=-Q1
S(s)+O2(g)===SO2(g) ΔH=-Q2
C. C(s)+1/2O2(g)===CO(g) ΔH=-Q1
C(s)+O2(g)===CO2(g) ΔH=-Q2
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-Q1
1/2H2(g)+1/2Cl2(g)===HCl(g) ΔH=-Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com