
(10分)完成下列离子方程式
(1)硫酸酸化的高锰酸钾溶液与草酸反应
(2)硫代硫酸钠与硫酸反应
(3)硫酸溶液与淀粉碘化钾溶液混合在空气中放置一段时间
(4)K2Cr2O7的溶液中存在的平衡
(5)氯化铁与硫氰化钾溶液反应
(1)2MnO4-+6H++5H2C2O4=2Mn2++8H2O+10CO2↑ (2)S2O32-+2H+=S+H2O+SO2↑
(3)4I-+O2+4H+=2I2+2H2O (4)Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
(5)Fe3++3SCN-=Fe(SCN)3
解析试题分析:(1)酸性高锰酸钾溶液能氧化草酸,反应的离子方程式为2MnO4-+6H++5H2C2O4=2Mn2++8H2O+10CO2↑。
(2)硫代硫酸钠在酸性溶液中中发自身的氧化还原反应,离子方程式为S2O32-+2H+=S+H2O+SO2↑。
(3)碘化钾易被空气中的氧气氧化,反应的离子方程式为4I-+O2+4H+=2I2+2H2O。
(4)K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O 2CrO42-+2H+。
2CrO42-+2H+。
(5)氯化铁与硫氰化钾溶液反应的离子方程式为Fe3++3SCN-=Fe(SCN)3。
考点:考查离子方程式的书写


科目:高中化学 来源: 题型:填空题
按要求完成下列填空
(l)写出下列物质的电离方程式:
Fe2(SO4)3__________________________________________________,
NaHCO3______________________________________________________。
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应____________________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________________。
(3)写出与下列离子方程式相对应的化学方程式:
H++OH-=H2O __________________________________________,
CO32-+2H+=CO2↑+H2O__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某无色透明溶液中可能存在大量Ag+、Mg2+、K+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是________,反应的离子方程式为_______________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为________________。
(4)原溶液中可能大量存在的阴离子是
| A.Cl- | B.NO3- | C.CO3 2- | D.OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某无色溶液中可能含有Na+、Ba2+、Fe3+、MnO4—、SO32—、Cl—、HCO3— 中的几种,依次进行以下实验,观察到的现象如下:①用PH试纸检验,溶液的PH>7;
②向溶液中滴加氯水,没有气体产生,得到无色溶液;
③向②的溶液中滴加硝酸酸化硝酸银溶液,产生白色沉淀;
④向②的溶液中滴加BaCl2溶液,产生不溶于盐酸的白色沉淀。
则(1)原溶液中一定含有的阴离子是 ;肯定没有的阳离子是 。
(2)步骤②的离子反应方程式为 。
(3)能否确定含有阳离子 ,(若有,写出离子符号,没有则写没有),其理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。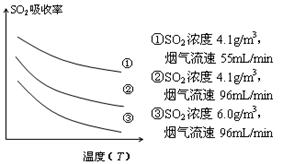
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。

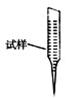
A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=IO3-+5I-+3H2O;KI+I2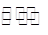 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为( )
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.氧化还原反应一定有氧元素参加 | B.失电子难的原子其得电子的能力一定强 |
| C.金属单质只具有还原性 | D.失电子越多,该物质的还原性就越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com