
����Ŀ��ijϡ�����ϡ����Ļ��Һ25mL���������������ۣ�������������ʵ����������������ӵı仯��ͼ��ʾ(����Ļ�ԭ����ΪNO�����Է�Ӧ�е���Һ����仯)�������й�˵��������ǣ� ��

A.OA�β�����������NO��AB�η����ķ�ӦΪFe��2Fe3��=3Fe2����BC�β�����������H2
B.�ɴ��ƶϸ������£������ԣ�NO3-ǿ��Fe3��
C.OA����BC�β���������������Ϊ1��1
D.C�����ʵ����ʵ���Ũ��Ϊ10 mol��L-1
���𰸡�C
��������
��ͼ���֪��������������OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O��AB�η�����ӦΪ��Fe+2Fe3+=3Fe2+��BC�η�����ӦΪ��Fe+2H+=Fe2++H2������������14.0gFe����Һ������ΪFeSO4������FeԪ���غ���Լ���n(FeSO4)���ٸ���������غ����ÿһ����Һ��n(H2SO4)������������������ʵ���Ũ�ȡ�
A. ������������OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O��AB�η�����ӦΪ��Fe+2Fe3+=3Fe2+��BC�η�����ӦΪ��Fe+2H+=Fe2++H2������A��ȷ��
B. ��ͼ���֪��OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O��AB�η�����ӦΪ��Fe+2Fe3+=3Fe2+��Fe�Ⱥ�NO3-��Ӧ���ٺ�Fe3����Ӧ��˵�������ԣ�NO3-ǿ��Fe3������B��ȷ��
C. OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O������![]() =0.1molFe������0.1molNO��BC�η�����ӦΪ��Fe+2H+=Fe2++H2��������
=0.1molFe������0.1molNO��BC�η�����ӦΪ��Fe+2H+=Fe2++H2��������![]() =0.1molFe������0.1molH2��ѡ��û��˵����������ͬ��ͬѹ�£������ж�����ȣ���C����
=0.1molFe������0.1molH2��ѡ��û��˵����������ͬ��ͬѹ�£������ж�����ȣ���C����
D. ��������14.0gFe����Һ������ΪFeSO4��n(FeSO4)= n(Fe)=![]() =0.25mol�����ʵ���Ũ��Ϊ
=0.25mol�����ʵ���Ũ��Ϊ![]() =10mol/L����D��ȷ��
=10mol/L����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijþ���Ͻ�MgxAly������x��yΪ��������������ϣ�����ͨ������������£���һ����ѧ�����ȵ�Al��Mg������һ���¶��������Ƶã�Ϊ�ⶨ�úϽ�ijɷ֣���ȡһ����������Ʒ����600mLϡ�����У���Ʒȫ���ܽⲢ�������壮����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ�����NaOH��Һ�������ϵ��ͼ��ʾ������������⣺
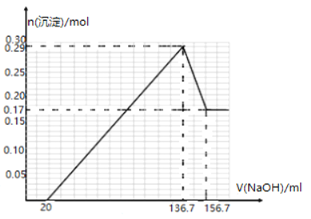
��1��������ȡþ���Ͻ�MgxAly��ʱͨ�������Ŀ����_____________��
��2��NaOH��Һ�����ʵ���Ũ��Ϊ____________��
��3����þ���Ͻ�MgxAly���Ļ�ѧʽΪ_____________��
��4���úϽ���һ������������Ļ�ѧ����ʽΪ��MgxAly+xH2�TxMgH2+yA1,�õ��Ļ������6.0mol��L-1HCl��Һ������ȫ�ͷų�H2��1mol MgxAly��ȫ�����õ��Ļ����������������ȫ��Ӧ���ͷų�H2�����ʵ���Ϊ__________________��
��5������þ���Ͻ�����NaOH��Һ���Թ���ԭ��أ�д�����������ķ�Ӧ_____________________��
��6����ͼ��Ϊ�״�ȼ�ϵ�أ��ҳ�Ϊ����Ʒ���桰�ۻ���װ�ã������ֱ�Ϊ����Ʒ��ʯī��M�缫�IJ�����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���غ͵����ػ������ڻ���ҽҩ���ϵ������й㷺��Ӧ�á��ش���������:
��1��IO3-���ӵ����幹�͵�����Ϊ____������ԭ�ӵ��ӻ���ʽΪ____��
��2��HIO4������ǿ��HIO3����ԭ��Ϊ____��
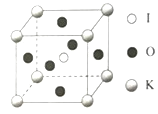
��3��KIO3������һ���������õķ����Թ�ѧ���ϣ�������ͼ���������ⳤΪa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã�K��I�����̾���Ϊ____nm����K���ڵ�O�ĸ���Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2SO3��һ�ְ�ɫ��ĩ����ҵ�Ͽ�������ԭ�����������ȡ�ij��ѧС��̽����ͬpH��Na2SO3��Һ��ͬŨ��AgNO3��Һ��Ӧ�IJ����������ʵ�顣
ʵ��� ����500 mL һ��Ũ�ȵ�Na2SO3��Һ
���ܽ⣺ȷ��ȡһ��������Na2SO3���壬����е�����ˮ�ܽ⡣����ˮ����е�ԭ����____
����Һ���������ܽ���Na2SO3��Һ���ձ�����ȴ��ת������A�У�������AΪ __��ͬʱϴ��____(����������)2~3�Σ���ϴ��Һһ��ת������A�У�
�۶��ݣ���ˮ���̶���1~2 cm�������ý�ͷ�ιܵμ�����ˮ��Һ����̶������У��Ǻ�ƿ�����������µߵ���ҡ�ȡ�
ʵ��� ̽����ͬpH��Na2SO3��Һ��pH=4��AgNO3��Һ��Ӧ�IJ���
�������ϣ�i.Ag2SO3Ϊ��ɫ���壬������ˮ�����ڹ���Na2SO3��Һ
ii.Ag2O���غ�ɫ���壬������ˮ������Ũ��ˮ��Ӧ
(1)��pH=8��Na2SO3��Һ����pH=4��AgNO3��Һ�У���������ɫ������
����һ���ð�ɫ����ΪAg2SO3
��������ð�ɫ����ΪAg2SO4
���������ð�ɫ����ΪAg2SO3��Ag2SO4�Ļ����
��д������һ�����ӷ���ʽ ____��
�����������Ŀ���������_____��
����֤�������Ƿ������ʵ�������____��
(2)��pH=4��AgNO3��Һ��ε���������pH=11��Na2SO3��Һ�У���ʼ������ɫ����A��Ȼ�����غ�ɫ���ʡ�Ϊ���о���ɫ����A�ijɷ֣�ȡ�غ�ɫ�����������ʵ�飺
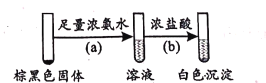
����֪��Ӧ(b)�Ļ�ѧ����ʽΪAg(NH3)2OH+3HCl=AgCl��+2NH4Cl+H2O����Ӧ(a)�Ļ�ѧ����ʽΪ____��
�����ɰ�ɫ����A�ķ�ӦΪ��������ԭ��Ӧ����A����Ҫ�ɷ���____(д��ѧʽ)��
(3)������ʵ���֪������Һ��ķ�Ӧ���ڶ����ԡ�����֤��(1)��ʵ�����һ��������(2)��ʵ��IJ��ﲻͬ��(1)ʵ��������� ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ����ж�����������ȷ���ǣ� ��
A.1mol H2ȼ�շų�������ΪH2��ȼ����
B.Na2SO3��H2O2�ķ�ӦΪ������ԭ��Ӧ
C.![]() ��
��![]() ��Ϊͬϵ��
��Ϊͬϵ��
D.BaSO4��ˮ��Һ�����磬��BaSO4���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��������ˮ��Һ�е�ƽ�����˽����Ĵ�����ʽ��
(1)��֪��������ĵ��볣�����±���

��д��H2S��Ka1�ı���ʽ��___________
�ڳ����£�pH��ͬ��������ҺNaF��Na2CO3��Na2S�����ʵ���Ũ����С����___________��
�۽�����H2Sͨ��Na2CO3��Һ����Ӧ�����ӷ���ʽ��_______________________________��
(2)�����£���0.100 mol��L��1 ������Һ�ζ�20.00 mL 0.100 mol��L��1 �İ�ˮ��Һ���ζ�������ͼ��ʾ��(������Һ����ı仯���٢��>����<������)

��a����ʾ����Һ��c(NH3��H2O)___________c(Cl��)��
��b����ʾ����Һ��c(Cl��)___________c(NH4��)��
��������pH��11�İ�ˮ��pH��5��NH4Cl��Һ�У���ˮ�������c(H��)֮��Ϊ__________��

(3)��Ԫ����H2A��Һ��H2A��HA����A2�������ʵ���������(X)��pH�ı仯��ͼ��ʾ����H2A�ڶ�������ƽ�ⳣ��Ka2��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶹��������Q�Ǻϳɿ�����������Ѫҩ���м��壬��ϳ�·����ͼ��
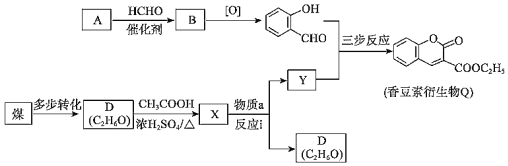
��֪����.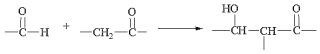
��.RCOOR��+R��OH��RCOOR��+R��OH
��1��A�ķ���ʽΪC6H6O�����뱥����ˮ��Ӧ���ɰ�ɫ������
�ٰ������ŷ��࣬A�������_____��
�����ɰ�ɫ�����ķ�Ӧ����ʽ��_____��
��2��A��B�ķ�Ӧ����ʽ��_____��
��3��D��X�ķ�Ӧ������_____��
��4������a�ķ���ʽΪC5H10O3���˴Ź����������������շ壬������;���ϳɣ�
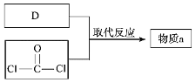
����a�Ľṹ��ʽ��_____��
��5����ӦiΪȡ����Ӧ��Yֻ��һ�ֹ����ţ�Y�Ľṹ��ʽ��_____��
��6�������㶹��������Q����������Ӧ����д�����������Ӧ����ʽ_____��
��7���о����֣�һ�������½��㶹��������Qˮ�⡢�ữ����![]() ����ˮ������ǿ���������ںϳ�����ҩ���˵����ˮ������ǿ��ԭ��_____��
����ˮ������ǿ���������ںϳ�����ҩ���˵����ˮ������ǿ��ԭ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��1���㽭��ѧ�ü״���CO��O2�ڳ�ѹ��ij�¶Ⱥʹ����������ºϳ�̼���������DMC�����о�������
��֪������ CO��ȼ���ȣ���H=-283.0 kJmol-1��
����1mol H2O(l)��ȫ�������H2O(g)������44 kJ��������
����2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+H2O(g) ��H=��15.5 kJmol-1
CH3OCOOCH3 (g)+H2O(g) ��H=��15.5 kJmol-1
��2CH3OH(g)+CO (g)+ 1/2O2(g) ![]() CH3OCOOCH3 (g)+H2O(l) ��H= ���÷�Ӧƽ�ⳣ��K�ı���ʽΪ�� ��
CH3OCOOCH3 (g)+H2O(l) ��H= ���÷�Ӧƽ�ⳣ��K�ı���ʽΪ�� ��
��2���״�Ҳ���Ʊ������һ����Ҫԭ�ϡ�ij�¶�ʱ����10mol����������ˮ����Һ�Լ��ԣ������Һ�еμ�1LijŨ�ȵļ��ᣬʹ��Һ�����ԣ���μӼ���Ĺ�����ˮ�ĵ���ƽ�⽫_____________(�������������) �ƶ�, ��������Һ������Ũ���ɴ�С��˳��Ϊ�� ��
���״���CO2��ֱ�Ӻϳ�DMC��2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+ H2O(g)�����״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ��������
CH3OCOOCH3 (g)+ H2O(g)�����״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ��������
��1���ں����ܱ������з���������Ӧ����˵����Ӧ�ﵽƽ��״̬���� ��ѡ���ţ���
A��2v��(CH3OH)=v��(CO2) B��CH3OH��H2O�����ʵ���֮�ȱ��ֲ���
C��������������ܶȲ��� D��������ѹǿ����
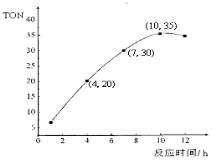
��2��ij�о�С����ij�¶��£���100mL�����ܱ�������Ͷ��2.5 mol CH3OH(g)������CO2��6��10-5 mol�������о���Ӧʱ��Լ״�ת����(TON)��Ӱ�죬��仯������ͼ��ʾ�����㹫ʽΪ��TON = ת���ļ״������ʵ���/���������ʵ������ڸ��¶��£���ѷ�Ӧʱ���� ��4��10 h��̼���������ƽ����Ӧ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����ijһ�ֻ�ѧԪ�ء�

����˵����ȷ����( )
A. �е�A2D<A2X
B. CA3�����ǷǼ��Է���
C. C�γɵĵ�������������������֮��Ϊ1��2
D. B��C��D�γɵ���̬�⻯�ﻥΪ�ȵ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com