
【题目】下列叙述正确的是( )
A.用水稀释0.1mol·L-1的氨水,则溶液中![]() 增大
增大
B.化学反应的反应热只与反应途径有关,而与反应体系的始态和终态无关
C.在等体积等pH的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸
D.两种氨水的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c2=10c1
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应的图象符合的是( )
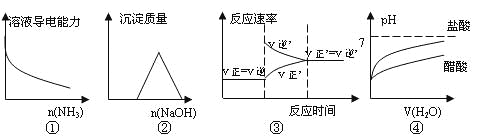
A.①是向一定量的CH3COOH溶液中通入氨气
B.②是向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.③是对于达到平衡状态的![]() 反应,在t1时缩小容器,并在t2时又达到平衡。
反应,在t1时缩小容器,并在t2时又达到平衡。
D.④是将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)用系统命名法命名下列物质或者根据名称写出对应的结构简式。
 _________________________
_________________________
3,4,4-三甲基-1-戊炔_________________________________
(2)写出下列物质中的官能团的名称。
![]() _________
_________
(3)苯环上含 -C2H5、-CH3、-Br三个取代基的同分异构体有_____种。
(4)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。

步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3 (如图Ⅰ)。
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。试填空:
①X的分子式为___________;X的习惯命名为___________;
②步骤二中的仪器分析方法称为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是( )

A.NH4HCO3溶液中存在下列守恒关系:c(NH![]() )+c(NH3·H2O)=c(HCO
)+c(NH3·H2O)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH![]() 和HCO
和HCO![]() 浓度逐渐减小
浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO![]() )>c(NH
)>c(NH![]() )>c(NH3·H2O)>c(CO
)>c(NH3·H2O)>c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体/ml | 280 | 336 | 336 |
(1)该盐酸的物质的量浓度____________;
(2)合金中Mg、Al的物质的量之比为___________;
(3)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为AlO2-,并使Mg2+刚好沉淀完全,则溶液中AlO2-的物质的量为__________mol;溶液中Na+的物质的量为_________mol;所加NaOH溶液的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为__。
(2)探究白色沉淀产生的原因,请填写实验方案:__、__。

查阅资料:
已知:①SCN-的化学性质与I-相似。
②2Cu2++4I-=2CuI↓十I2。
则Cu2+与SCN-反应的离子方程式为__。
实验II:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因:__。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应,
反应II:Fe2+与NO反应。
①依据实验现象,可推知反应I的速率比反应II__(填“快"或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明___。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
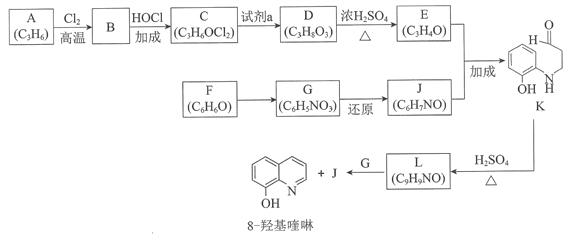
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
已知:i. 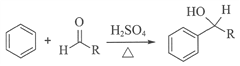
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________
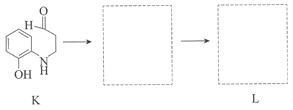
(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com