
| A、在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有还原性 |
| B、实验室从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取 |
| C、燃料电池制作实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果更好 |
| D、润洗滴定管时应从滴定管上口加入润洗溶液,倾斜着转动滴定管使液体润湿内壁,再从上口倒出,重复2-3次 |


科目:高中化学 来源: 题型:
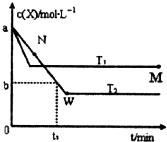 在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0?t1时间内,υ(Y)=
| ||
| C、M点的平衡常数比W点的平衡常数小 | ||
| D、M点时再加入一定量的X,平衡后X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ②乙烯 ③CH3COOH
②乙烯 ③CH3COOH
| A、①⑤ | B、①②④⑥ |
| C、①④ | D、①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
| B、相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
| C、0.2 mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+) |
| D、等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的强 |
| C、M与Z形成的化合物中只存在离子键 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理量 实验序号 | V[0.10mol?L-1FeSO4] /mL | | | KMnO4溶液褪色所需时间t/s |
| 1 | a | | t1 | |
| 2 | a | t2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | n(PCl5)/mol | n(PCl3)/mol | n(Cl2)/mol |
| 0 | 0.5 | 0 | 0 |
| t1 | 0.45 | ||
| t2 | 0.1 | ||
| t3 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏、石油的裂解过程中都发生了化学变化 |
| B、玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 |
| C、用纯碱溶液清洗油污时,加热可以提高去污能力 |
| D、高纯硅广泛应用于太阳能电池、计算机芯片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com