
电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题。
方法一:称取1.40 g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色
气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448 mL(不考虑乙炔在水中的溶解,
下同)。
(1)电石水解生成乙炔气体的化学方程式为:
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称。

(3)对获得准确的气体体积无益的操作有 (填序号)
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平
(4)由以上数据可计算出样品中CaC2的质量分数为____ 。
方法二:称取l.40g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高
温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+
5O2=2CaO+ 4CO2。

(5)反应完成后,石英管内样品易与管壁产生腐蚀,试用化学方程式解释其原因
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为
(7)由此方法测得的样品中CaC2的质量分数比方法一中的____ (填“大”、“小”或“相
等”),从实验装置的角度看,原因为 。
(1)CaC2+2H2O→Ca(OH)2+C2H2↑(2分,用等号连接不扣分)
(2)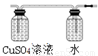 (图及试剂均正确得2分,B中也可装入NaOH溶液)
(图及试剂均正确得2分,B中也可装入NaOH溶液)
(3)③(1分) (4)91.43%(2分) (5)CaO + SiO2 CaSiO3(2分)
CaSiO3(2分)
(6)除去CO2中混有的SO2等(2分)
(7)大(2分) a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大(2分)
【解析】
试题分析:(1)电石与水反应生成碳化钙和乙炔,因此电石水解生成乙炔气体的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑。
(2)由于生成的乙炔气体中含有杂质,因此需要利用硫酸铜溶液或氢氧化钠溶液除去。乙炔的密度和空气很接近,一般用排水法收集,所以正确的连接是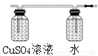 。
。
(3)①检查装置的气密性,可以防止生成的乙炔损失,因此对获得准确的气体体积有益;②恢复到室温后再上下调整量筒位置,使C、D两液面相平可以使内外压强相等,对获得准确的气体体积有益;③由于反应前装置中就存在空气,所以在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中对获得准确的气体体积无益;④读数时视线与量筒内凹液面最低点相平对获得准确的气体体积有益,因此答案选③。
(4)乙炔的物质的量是0.448L÷22.4L/mol=0.02mol,则根据方程式可知碳化钙的物质的量也是0.02mol,其质量=0.02mol×64g/mol=1.28g,所以碳化钙的质量分数=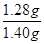 ×100%=91.43%。
×100%=91.43%。
(5)由于碳化钙生成的氧化钙是碱性氧化物,能和玻璃中的二氧化硅反应生成硅酸钙,从而腐蚀管壁,反应的化学方程式是CaO + SiO2 CaSiO3。
CaSiO3。
(6)由于电石中含有杂质元素S等,在反应中生成SO2,也能被氢氧化钠溶液吸收干扰CO2的测量,所以需要酸性高锰酸钾溶液除去CO2中混有的SO2等杂质气体。
(7)由于空气中也含有CO2,因此a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大。
考点:考查电石中碳化钙含量测定的有关实验探究以及实验设计与评价等


科目:高中化学 来源:2012-2013学年河北省邯郸市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
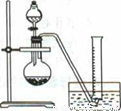
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽 、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□ 。若该实验生成的 C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com