
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:
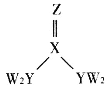
且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
A.YW3分子中的键角为120°
B.W2Z的稳定性大于YW3
C.物质甲分子中存在6个σ键
D.Y元素的氧化物对应的水化物为强酸
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子序数逐渐增大,根据四种元素形成的化合物结构,其中各原子的核外电子排布均处于稳定结构。根据图示可知,X原子最外层含有4个电子,Y原子最外层含有5个电子,Z原子最外层含有6个电子,W最外层含有1个或7个电子,结合原子序数及“W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体”可知,W为H,X为C,Y为N,Z为O元素,据此分析解答。
根据分析可知,W为H,X为C,Y为N,Z为O元素。
A.YW3为NH3,为三角锥形的分子,分子中的键角<120°,故A错误;
B.非金属性越强,氢化物越稳定,水的稳定性大于氨气,故B正确;
C.物质甲的结构简式为CO(NH2)2,存在7个σ键和1个π键,故C错误;
D.N元素的氧化物对应的水化物可能是硝酸,也可能为亚硝酸,其中亚硝酸为弱酸,故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含Cr2O72-废水(pH约为6)和淡化食盐水,其装置示意图如下图所示。图中,D和E为阳离子交换膜或阴离子交换膜,Z为待淡化食盐水。已知Cr3+完全沉淀所需的pH为5.6。下列说法不正确的是
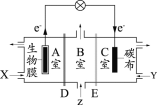
A.E为阴离子交换膜
B.X为有机物污水,Y为含Cr2O72-废水
C.理论上处理1mol的Cr2O72-的同时可脱除6mol的NaCl
D.C室的电极反应式为Cr2O72- + 6e- + 8H+=2Cr(OH)3↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]一定增大
B. 向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
C. 向0.1 mol·L-1的NaHSO3溶液中加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
D. 可用浓度大于0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃[已知Ksp(BaSO4)=1.1×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记最的实验现象如下表所示:
开始时 | 5min 后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是_______________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是____________________________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV;分别取少量 5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。试用方程式解释溶液中出现Fe2+的原因______________________________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与SO32-的氧化还原反应:
②NO3-可以______________________________;
③NO3-在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(己知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mLpH=1.0的0.4mol/L Fe(NO3)3溶液中溶解 固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加 入2滴0.4mol/LNa2SO3溶液。向其中滴入少量BaCl2溶液 | _______________________。 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述时间,以下结果或推论合理的是_______________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验1的上层淸液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物L:是一种来源于生物学灵感的新型粘合剂。下列关于高聚物L的说法中,不正确的是
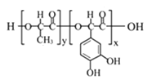
A. 单体之一为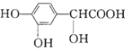
B. 在一定条件下能发生水解反应
C. 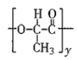 的结构中不含酯基
的结构中不含酯基
D. 生成1mol L的同时,会有(x+y-1)mol H2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
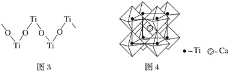
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
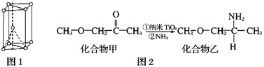
(1)金属钛晶胞如图1所示,为___________堆积(填堆积方式)。
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是________________。
(3)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为_______________。
(4)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被__________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围,钙钛矿晶体的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com