
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加______ ______ | 若______,则假设______成立. |
| 步骤:2:另取少许反应后溶液于试管中,滴加______ | 若______,则假设______成立. 若 ______, 则假设3成立. |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加1mol/L的CuSO4溶液 | 若溶液中出现黑色沉淀,则假设1成立. |
| 步骤:2:另取少许反应后溶液于试管中,滴加1-2滴淀粉KI溶液 | 若溶液变蓝,则假设 2成立. 若 步骤1中没有出现黑色沉淀,步骤2中溶液不变蓝色, 则假设3成立. |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
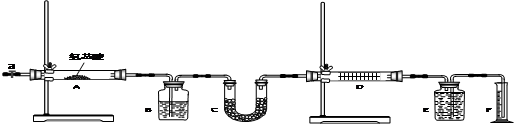
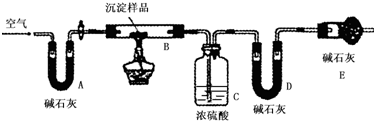
| B装置的质量(g) | C装置的质量(g) | D装置的质量(g) | |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com