
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ����ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��WԪ�������ڱ��е�λ��
��2��X��Y��Z��W�ֱ��γɵļ����ӵİ뾶��С�����˳��Ϊ���������û�ѧʽ��д����ͬ����Y��Z��Ӧ����̬�⻯����ȶ����� ��
��3����һ�������£���Ԫ��Y��Z��ɵ�һ����̬������ɷ�����������Ӧ����Ӧ��ƽ��ʱ��������̬���ʹ��棬��֪ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��4����ҵ�Ͻ������W����ͨ�����ڵ�Z�����п��Ƶû�����Z2W2 �� �����ʿ���ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬д��Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1���������ڵ�VIIA��
��2��O2����N3����Cl����S2����H2O��H2S
��3��2SO2��g��+O2��g��?2SO3��g����H=��190.0kJ?mol��1
��4��2S2Cl2+2H2O=SO2+3S+4HCl
���������⣺��1��WΪClԪ�أ��������ڱ��е������ڵ�VIIA �壬���Դ��ǣ��������ڵ�VIIA �壻��2����������Ų���ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�������Ӻ�����Ӳ���Խ�࣬���Ӱ뾶Խ���������Ӱ뾶O2����N3����Cl����S2�� �� �ǽ�����Խǿ����̬�⻯����ȶ���Խǿ�����ڷǽ����ԣ�O��S��������̬�⻯����ȶ��ԣ�H2O��H2S�����Դ��ǣ�O2����N3����Cl����S2����H2O��H2S����3����һ�������£�������Q��Y�ĵ��ʷ�Ӧ��ƽ��ʱ��������̬���ʣ���Ӧ����ʽΪ��2SO2+O22SO3 �� ��Ӧʱ��ÿת��4mol���ӷ���190.0kJ����μӷ�Ӧ��������Ϊ ![]() =2mol���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2SO2 ��g��+O2��g��2SO3��g����H=��190.0 kJmol��1 ��
=2mol���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2SO2 ��g��+O2��g��2SO3��g����H=��190.0 kJmol��1 ��
���Դ��ǣ�2SO2��g��+O2��g��2SO3��g����H=��190.0 kJmol��1����4��������S2Cl2����ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬������ΪSO2 �� 0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬��SԪ�ػ��ϼ۽��ͣ�ת��0.3mol�������ɶ�������Ϊ0.1mol������0.3molSԭ�ӷ�����ԭ��Ӧ�����ݵ���ת���غ��֪SԪ���ڻ�ԭ�����еĻ��ϼ�Ϊ0��������S��ͬʱ����HCl���÷�Ӧ�Ļ�ѧ����ʽΪ��2S2Cl2+2H2O�T3S��+SO2��+4HCl��
���Դ��ǣ�2S2Cl2+2H2O=SO2+3S+4HCl��


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һЩ�����л����ת����ϵ�����ڷ�Ӧ�١��ߵ�˵������ȷ���ǣ� �� 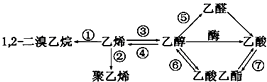
A.��Ӧ�٢��Ǽӳɷ�Ӧ
B.��Ӧ���ǼӾ۷�Ӧ
C.ֻ�з�Ӧ����ȡ����Ӧ
D.��Ӧ������ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˫���ű�ʾ���з�Ӧ�ĵ���ת�Ʒ������Ŀ�����ش��������⣺3I2+6NaOH=5NaI+NaIO3+3H2O
��1�������������ǻ�ԭ����������������
��2���������뻹ԭ�������ʵ���֮��Ϊ �� ����Ӧ����3mol NaOHʱ��ת�Ƶĵ�����ĿΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����RNH2+R��CH2Cl ![]() RNHCH2R��+HCl��R��R����������� �ڱ���ͬϵ���ܱ���������������磺
RNHCH2R��+HCl��R��R����������� �ڱ���ͬϵ���ܱ���������������磺 ![]()
![]()
![]()
�� ![]()
![]()
![]() �������������ԣ��ױ�������������C����ȡ�����飨����ʹ�����м�����ϳ�·����ͼ��ʾ��
�������������ԣ��ױ�������������C����ȡ�����飨����ʹ�����м�����ϳ�·����ͼ��ʾ��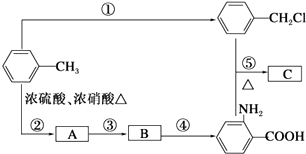
��ش��������⣺
��1��B���ʵĽṹ��ʽ�� ��
��2��д����Ӧ�١��ڵĻ�ѧ����ʽ�� ����
�� ��
��3����Ӧ�١����У�����ȡ����Ӧ�������Ӧ��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����һ������ת��Ч�ʸߡ��Ի����ѺõĻ�ѧ��Դ����ͼΪһ������ȼ�ϵ�صĽṹװ�á�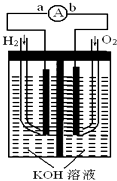
��1���缫bΪ��ȼ�ϵ�ص�������������������缫����ʽΪ��
��2����ع���ʱ����Һ�е�OH�����������a����b������
��3����ع���ʱ���ڵ����е�����������Ϊ����a��b��ʾ����
��4�����ʹ��һ��ʱ�����Һ��pHֵ�������С������
��5������ع���һ��ʱ������ı�״����H2 Ϊ6.72Lʱ��ת�Ƶ��� mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У���ѧ��������ȫ��ͬ���ǣ�(����)
A. HCl ��NaOHB. Na2O ��Na2O2
C. CO2�� CaOD. CaCl2�� Na2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.Zn��Ũ���ᷴӦ Zn+2H+�TH2��+Zn2+
B.����ˮ��Ӧ��Na+2H2O�TNa++2OH��+H2��
C.��������Һ���������������Һ��Ӧ��Al3++4OH���TAlO ![]() +2H2O
+2H2O
D.��Ca��ClO��2��Һ��ͨ������CO2��ClO��+H2O+CO2�THClO+HCO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��3CH4��g��+2N2��g��3C��s��+4NH3��g����H��0��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[ ![]() ]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� ��
]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� �� 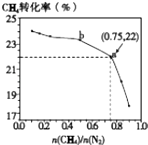
A.![]() Խ��CH4��ת����Խ��
Խ��CH4��ת����Խ��
B.![]() ����ʱ�������£�NH3���������������
����ʱ�������£�NH3���������������
C.b���Ӧ��ƽ�ⳣ����a��Ĵ�
D.a���Ӧ��NH3���������ԼΪ26%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com