
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、电镀时,常采用镀层金属作阳极,含镀层金属阳离子的溶液作电解质溶液 |
| C、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
| D、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |


科目:高中化学 来源: 题型:
| A、CO2 |
| B、Al(OH)3 |
| C、H2CO3 |
| D、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| Br2 |
| Na醇溶液 |
| △ |
| 溴水 |
| NaOH水溶液 |
| O2,催化剂 |
| △ |
| O2,催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
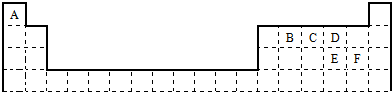
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、G→a→e→b→f→d→c |
| B、G→c→d→b→e→f→a |
| C、G→a→e→f→b→d→c |
| D、G→b→e→f→a→d→c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法 | B、水洗法 |
| C、分液法 | D、过滤法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 燃烧热/kJ?mol-1 | 化合物 | 燃烧热/kJ?mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A、正戊烷的燃烧热大约在3520 kJ?mol-1左右 |
| B、热稳定性:正丁烷<异丁烷 |
| C、乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H=-1560.8kJ?mol-1 |
| D、相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com