
【题目】下列叙述中正确的是
A. CS2为V形的极性分子,形成分子晶体
B. ClO3-的空间构型为平面三角形
C. NCl3的N-Cl键长大于NH3的N-H键长,由此可推知NCl3的沸点低于NH3
D. SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
【答案】D
【解析】A.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故A错误;B.ClO3-中Cl的价层电子对数=3+![]() (7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;C.NCl3的N-Cl键长大于NH3的N-H键长,键长影响化学性质,而NH3分子间有氢键,导致其沸点高于NCl3,故C错误;D.SiF4中Si的价层电子对数=4+
(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;C.NCl3的N-Cl键长大于NH3的N-H键长,键长影响化学性质,而NH3分子间有氢键,导致其沸点高于NCl3,故C错误;D.SiF4中Si的价层电子对数=4+![]() (4-1×4)=4,SO32-中S的价层电子对数=3+
(4-1×4)=4,SO32-中S的价层电子对数=3+![]() (6+2-2×3)=4,所以中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形,故D正确,答案为D。
(6+2-2×3)=4,所以中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形,故D正确,答案为D。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
乙:![]() 无色,无气味并且易燃.是常见的一种基础能源,17年5月18日,我国首次开采成功它的水合物并连续产量,可解千年能源之忧。
无色,无气味并且易燃.是常见的一种基础能源,17年5月18日,我国首次开采成功它的水合物并连续产量,可解千年能源之忧。
丙:![]() 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.
请根据上述信息回答下列问题.
(1)B元素在元素周期表中的位置为_____,请写出BC2分子的电子式:______.
(2)A、E、F在同一周期,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应:________________________________.
②F、C两种元素组成的化合物Y可作为耐高温结构的材料,X与Y两种化合物在溶液中发生反应的离子方程式:_________________________________________________.
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液.滴加过程中的现象为:①试管中溶液变成深棕黄色,②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀.请回答“片刻后反应变得剧烈”的原因
a_____________________b_________________.
(4)物质戊的元素组成和乙相同,戊分子具有18电子结构.与乙互为同系物,则戊的氯取代有机物的共________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如图所示。随着科学技术的发展,测定阿伏伽德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取mgNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
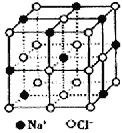
(1)步骤①中A仪器最好用_________(填仪器名称)
(2)能否用胶头滴管代替步骤②中的滴定管________,其原因是____________。
(3)经X射线衍射测得NaCl晶胞中最邻近的Na+和Cl-平均距离为acm,则利用上述方法测得的阿伏伽德罗常数的表达式为NA=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,可能大量共存的是
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下, ![]() =0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体化学成分的叙述,正确的是( )
A. 精瘦肉中含量最多的是蛋白质
B. 组成细胞壁主要成分的单体是氨基酸
C. T2噬菌体的遗传物质含硫元素
D. 与精子形成相关的雄激素属于脂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是_______________,①的反应类型是_______________。
(2)B中含有的官能团是_______________(写名称),
(3)D聚合生成高分子化合物的化学方程式为________________。
(4)反应③的化学方程式是___________________。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为_________________。
(6)分子式C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有__________________种(不考虑立体异构)。
(7)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)。____________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com