
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是( )
A. 用图所示装置制取少量纯净的CO2气体
B. 如图所示,用CCl4提取溴水中的Br2
C. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
D. 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
科目:高中化学 来源: 题型:
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AsO43-+2I-+2H+ ![]() AsO33-+I2+H2O设计成图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
AsO33-+I2+H2O设计成图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐置滴加入40%NaOH溶液,下列描述中,正确的是

A. 甲组操作过程中,C2做负极
B. 乙组操作过程中,C1上发生的电极反应为: 2I—-2e—=I2
C. 两次操作过程中,微安表(G)指针的偏转方向相反
D. 甲组操作时该装置为原电池,乙组操作时该装置为电解池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳纶可以制成防弹衣、防弹头盔、防弹装甲等,对位芳纶纤维J(聚对苯二甲酰对苯二胺)是重要的国防军工材料。化合物A、乙烯、苯制备J的一种合成路线如下:

回答下列问题:
(1)A的化学名称为____________________。
(2)A→B的反应类型是____________________。
(3)实验室由苯制备F所需试剂、条件分别为____________________。
(4)G中官能团的名称是____________________。
(5)E与I反应生成J的化学方程式为____________________。
(6)写出与D互为同分异构体的只含酯基的结构简式(核磁共振氢谱为四组峰,峰面积比为2:2:1:1____________________。
(7)参照上述合成路线,以1,3-戊二烯和丙烯为原料(无机试剂任选),设计制备邻苯二甲酸的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业氧化铍可生产金属铍、制作铍合金及特殊陶瓷。由绿柱石(含3BeO·Al2O3·6SiO2及铁等微量元素)和方解石(主要成分是CaCO3)为原料生产氧化铍的工艺流程如下:

已知:Be与Al性质相似。下列叙述错误的是
A. “浸渣”受热后的主要成分是SiO2和CaSO4
B. 利用“碱溶渣”可回收金属铁
C. “水解,调节pH”反应的主要离子是BeO22-
D. 上述流程中“碱、水”宜使用廉价的氨水,降低生产成本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
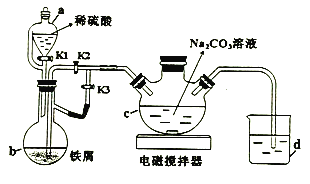
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com