
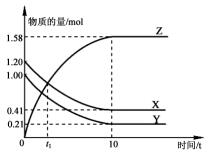
 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | t1时,Z和X的浓度相等,达到了化学平衡状态 | |
| C. | 反应开始到10 s时,Y的正逆反应速率都相等 | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
分析 A.由图可知,10s内Z的物质的量变化量为1.58mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(Z);
B.在t1时刻之后,X的物质的量进行减小,Z的物质的量进行增大,反应向正反应进行;
C.反应开始到10 s时,随时间增加物质的量不变说明Y的正逆反应速率都相等;
D.根据物质的量的变化,判断出反应物、生成物及是否是可逆反应,利用物质的量之比化学计量数之比书写方程式.
解答 解:A.10s内,用Z表示的反应速率为v(Z)=$\frac{\frac{1.58mol}{1L}}{10s}$=0.158moL/(L•s),故A正确;
B.t1时,Z和X的浓度相等,在t1时刻之后,X的物质的量进行减小,Z的物质的量进行增大,反应向正反应进行,反应未达到了化学平衡状态,故B错误;
C.10s后随时间增加物质的量不变,说明反应开始到10 s时,Y的正逆反应速率都相等,反应达到平衡状态,故C正确;
D.由图象可以看出,由图表可知,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)?2Z(g),故D错误;
故选AC.
点评 本题考查化学反应速率的有关计算,分析图象注意一看点:即起点、拐点、交点、终点;二看线:即看曲线的变化趋势和走向;三看面:即看清纵坐标、横坐标表示的物理量等,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:实验题
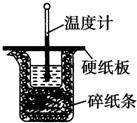 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 复分解反应 | C. | 分解反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L水中含有的氢氧键数为NA | |
| B. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| C. | 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA | |
| D. | 在反应2Na2O2+2CO2═2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
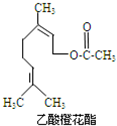 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性:I2>Br2>Cl2 | B. | 热稳定性:PH3>H2S>HCl | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
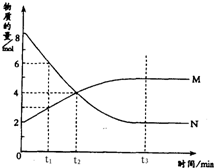 在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t1时,N的浓度是M浓度的2倍 | |
| B. | 反应的化学方程式为N?2M | |
| C. | t2时,正逆反应速率相等,达到平衡状态 | |
| D. | t3时,正反应速率小于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Mg与稀硫酸和CO2均能反应,其反应类型相同 | |
| B. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| C. | SO2气体通入紫色石蕊试液中,溶液先变红后褪色 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com