
����Ŀ��ʵ������ȡ���������ռ������漰���¼�����Ҫ�Σ�![]()
![]()
![]()
![]() �����
�����
��1��д��ʵ������ȡCl2�����ӷ���ʽ______________________��NA��ʾ�����ӵ�����������4mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ___________��
��2����������3���Լ���A������ʳ��ˮ B��Ũ���� C��NaOH��Һ
���������Լ���ѡ�ش���գ�
X��ҺӦѡ��_________����д��ţ���Y�Լ�������____________________��
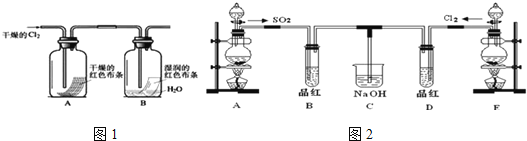
��3��ij��ѧ��ȤС��Ϊ��̽��Cl2��������ʣ��������ͼ1��ʵ�飮
ͨ��Cl2�ӹ۲켯��ƿA��B�е�����ɵó��Ľ�����_____________��д����ѧ��Ӧ����ʽ�����ü�Ҫ���ֽ��ͣ���
��4��ij��ȤС���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ��������ͼ2��ʵ��װ�ã�
��ʵ������װ��A�Ʊ�SO2��ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������©����Һ��δ���£�����Ϊԭ������ǣ�______________________��
����Ӧ��ʼһ��ʱ��۲쵽B��D���Թ��е�Ʒ����Һ��������ɫ������������ɫԭ����ͬ�������������������ʵ�飬��IJ�����_________________��
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O 2NA A ��ȥ�����л��е�ˮ����������������� Cl2+H2O=HClO+HCl����������Ư�� ����Һ©���IJ�����û��ȡ���� ��ֹͣͨ�����ٸ�B��D�����Թֱܷ����
MnCl2+Cl2��+2H2O 2NA A ��ȥ�����л��е�ˮ����������������� Cl2+H2O=HClO+HCl����������Ư�� ����Һ©���IJ�����û��ȡ���� ��ֹͣͨ�����ٸ�B��D�����Թֱܷ����
��������
��1������������Ũ�����ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����ѧ����ʽ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O�����ݷ���ʽ��֪ÿ����1mol��������4mol�Ȼ���μӷ�Ӧ������ֻ��2mol�Ȼ����Щ�1��������Ϊ������0�ۣ�ʧȥ2mol���ӣ�������4mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ2NA��
MnCl2+Cl2��+2H2O�����ݷ���ʽ��֪ÿ����1mol��������4mol�Ȼ���μӷ�Ӧ������ֻ��2mol�Ȼ����Щ�1��������Ϊ������0�ۣ�ʧȥ2mol���ӣ�������4mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ2NA��
��2��Ũ��������ӷ��ԣ��Ʊ��������к����Ȼ����ˮ�����������Ȼ��⼫������ˮ�������ڱ���ʳ��ˮ���ܽ�Ȳ�������X��ҺΪ����ʳ��ˮ�����ó�ȥ�����е��Ȼ��⣬Ũ���������ˮ��ѡ����ʵij��Ӽ�������YΪŨ���ᣬ���ø���������
��3��ͨ��Cl2��A�и��ﲼ������ɫ��B��ʪ������ɫ����֤������������Ư���ԣ�������ˮ��Ӧ�����Ȼ���ʹ����ᣬ���������Ư���ԣ�����ʽ��Cl2+H2O=HClO+HCl��
��4����ʹ�÷�Һ©��ʱӦȡ�����ӣ�ʹ��Һ©���ڵ�ѹǿ���ڴ���ѹǿ����֤Һ��˳����������Һ©�����������е�Һ�岻�����£����ܵ�ԭ���Ƿ�Һ©��ƿ��δ��
����������Ư���Ծ��в��ȶ��ԣ������ָ���ɫ��������Ư�����ȶ��ԣ����Ȳ��ָ���ɫ������Ϊ������߿��Խ������²�����ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���ʼ��仯�����ںܶ���������Ҫ����;�������ͭ����������ߵ��£���ˮ����ͭ������ɱ������
(1)Cuλ��Ԫ�����ڱ���I B�塣Cu2���ĺ�������Ų�ʽΪ__________��
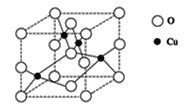
(2)��ͼ��ͭ��ij��������ľ����ṹʾ��ͼ����ȷ���þ����������ӵĸ���Ϊ_____��
(3)������ͭ��Һ�м��������ˮ��������[Cu(NH3)4]2�������ӡ���֪NF3��NH3�Ŀռ乹�Ͷ��������Σ���NF3������Cu2���γ������ӣ���ԭ����_______________��
(4)Cu2O���۵��Cu2S��_________(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������������ʣ���22g������̼��8g������1.204��1024���������Ӣ�4��ʱ18mLˮ��������������������_______,����ԭ��������______,����������_____����������������__________������ţ�
��2��12.4 gNa2R��Na+0.4mol,��Na2R��Ħ������Ϊ__________,R�����ԭ������Ϊ__________,��R������Ϊ1.6g��Na2R,�����ʵ���Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ������н�������ȷ����

��ͭΪ������пΪ��������ͭ���������ݣ���SO42-��ͭ���ƶ�����п������ԭ��Ӧ���ݵ��ӵ�������ͭ��п��������Ӧʽ��Zn-2e����Zn2��
A. �٢�B. �٢ܢ�
C. �ڢܢ�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ჴ��������![]() ��һ�ָ�Ч�Ͷ��ķ�����
��һ�ָ�Ч�Ͷ��ķ�����![]() ij�о�С����õĺϳ�·�����£�
ij�о�С����õĺϳ�·�����£�
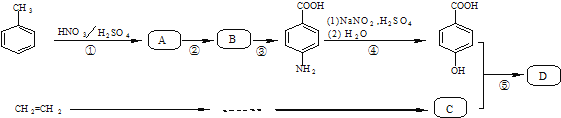
��֪��
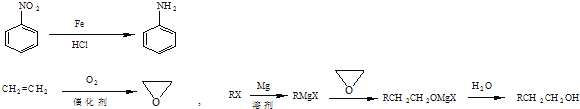
��ش��������⣺
![]() ������B�������� ______ �����еĹ������� ______ ��
������B�������� ______ �����еĹ������� ______ ��
![]() ��
��![]() ������ ______ ��Ӧ
������ ______ ��Ӧ![]() �Ӧ����
�Ӧ����![]() ��
��
![]() �����ķ�Ӧ�����ܵߵ����������� ______ ��
�����ķ�Ӧ�����ܵߵ����������� ______ ��
![]() ��д��ͬʱ��������������A��ͬ���칹��Ľṹ��ʽ ______
��д��ͬʱ��������������A��ͬ���칹��Ľṹ��ʽ ______ ![]() ��д3��
��д3��![]() ��
��
![]() ���ӽṹ����ȩ��
���ӽṹ����ȩ��
![]() ����ʾ�б������ұ�����ֻ��������ԭ��
����ʾ�б������ұ�����ֻ��������ԭ��
![]() ���
д����![]() ����Ӧ�Ļ�ѧ����ʽ ______ ��
����Ӧ�Ļ�ѧ����ʽ ______ ��
![]() ������ϩΪԭ�ϣ��������������Ϣ����ƻ�����C�ĺϳ�·��
������ϩΪԭ�ϣ��������������Ϣ����ƻ�����C�ĺϳ�·��![]() ���Լ����ܼ���ѡ
���Լ����ܼ���ѡ![]() �ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
�ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��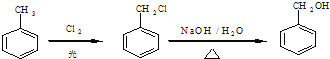 _______________
_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaBH4ȼ�ϵ�ؾ������۵�ѹ�ߡ������ܶȴ���ŵ㡣�Ը�ȼ�ϵ��Ϊ��Դ��⾫��ͭ��װ����ͼ��ʾ������˵������ȷ����
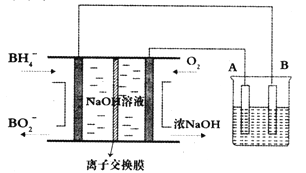
A. ���ӽ���ĤӦΪ�����ӽ���Ĥ,Na+���������Ҽ���Ǩ��
B. ��ȼ�ϵ�صĸ�����ӦʽΪBH4-+8OH--8e-=BO2-+6H2O
C. �����еĵ������Һ����ѡ��CuSO4��Һ
D. ÿ����2.24LO2(��״��)ʱ��A�缫����������12.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о�̼Ԫ�صĻ���������Ҫ���壬�ش��������⣺
��1����֪�ڳ��³�ѹ�£���CH3OH(l)+O2(g)=CO(g)+2H2O(g) ��H=��359.8kJ��mol��1
��2CO(g)+O2(g)=2CO2(g) ��H=��556.0kJ��mol��1
��H2O(g)=H2O(l) ��H=��44.0kJ��mol��1
д�����ּ״�ȼ���ȵ��Ȼ�ѧ����ʽ______________��
��2���ں��¡������ܱ������м���H2C2O4��������Ӧ��H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g)������������˵����Ӧ�Ѿ��ﵽƽ��״̬����_____��
CO2(g)+CO(g)+H2O(g)������������˵����Ӧ�Ѿ��ﵽƽ��״̬����_____��
A��ѹǿ���ٱ仯 B��CO2(g)������������ֲ���
C�����������ܶȲ��ٱ仯 D����������ƽ��Ħ���������ֲ���
��3���ϳ����صķ�ӦΪ 2NH3(g) + CO2(g) =CO(NH2)2(s) + H2O(g)��t��ʱ�������ݻ�Ϊ2L���ܱ������м���3mol NH3��1molCO2���ﵽƽ��ʱ��������ѹǿΪ��ʼʱ��0.75������t��ʱ�Ļ�ѧƽ�ⳣ��Ϊ_____���������������䣬����������м���0.5molCO2��1molH2O��NH3��ת���ʽ�_____(����������������С������������)��
��4���û�ѧ�����������ִ�ƽ���ƶ��ĽǶȷ���AlCl3��Һ�����ܽ�CaCO3�����ԭ����__________��
��5�������£����ijCaCO3�ı�����ҺpH=10.0������CO32���ĵڶ���ˮ�⣬̼�����Ũ��ԼΪc(CO32-)=____mol/L��(��֪��Ka1(H2CO3)=4.4��10-7 Ka2(H2CO3)=4.7��10-11)��̼��Ʊ�����Һ�е�����Ũ���ɴ�С����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪32gA��40gBǡ����ȫ��Ӧ������mgC��9gD������ͬ�����£�16gA��30gB��Ϸ�Ӧ����0.25molC������Ħ��D��������C��Ħ������Ӧ�ǣ� ��
A.63g/molB.122g/molC.126g/molD.163g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���п�ѧ�Ҿ����о����֣���CO2��H2��210~290�������������¿�ת�����ɼ״�������ˮ������
��230������������Ͷ��0.5molCO2��1.5molH2����ת���ʴ�80��ʱ�ų�����19.6kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ_________ ��
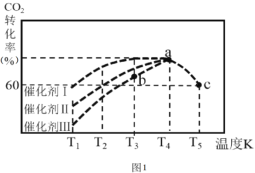
��һ�������£���2L�����ܱ������г���1.0molCO2��3.0molH2���ڲ�ͬ���������£���ͬʱ����CO2��ת�������¶ȱ仯��ͼ��ʾ������Ч����ѵ��Ǵ���______ (����I��������)��b��v(��) ____v(��) (��>��< ��=)���˷�Ӧ��a��ʱ�Ѵ�ƽ��״̬�� a���ת���ʱ�c��ߵ�ԭ����_______����֪�����ڵ���ʼѹǿΪ100kPa����ͼ��c���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=________��(������λ��Ч����) (KpΪ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
II������β����CO��NOx�Լ�ȼú�����е�SO2���Ǵ�����Ⱦ������ǵ�����������Ҫ���塣
(1)����SO2��NO�����Na2S2O4��NH4NO3��Ʒ������ͼ��ͼ��ʾ(CeΪ��Ԫ��)��
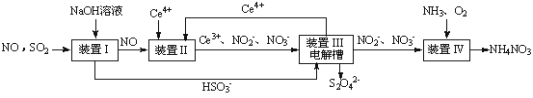
װ�����У�����������NO��Ce4+�����IJ�����Ҫ��NO3-��NO2-����д������NO3-��NO2-���ʵ���֮��Ϊ2��1ʱ�����ӷ���ʽ��________________________��
(2)װ����������֮һ�������ӽ���Ĥ���۵��ʹ��Ce4+����������ʱ���ɵ�Ce4���ڵ��۵�____(��������������������)��ͬʱ����һ������S2O42-�ĵ缫��ӦʽΪ_________��
(3)��֪����װ��������Һ��NO2-��Ũ��Ϊa g��L-1��Ҫʹ1.5 m3����Һ�е�NO2-��ȫת��ΪNH4NO3����������װ������ͨ���״���µ�����__________L(�ú�a����ʽ��ʾ���������������������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com