
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式______________。
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化 D.混合气体的平均摩尔质量保持不变
(3)合成尿素的反应为 2NH3(g) + CO2(g) =CO(NH2)2(s) + H2O(g)。t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。则t℃时的化学平衡常数为_____,若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将_____(填“增大”、“减小”或“不变”)。
(4)用化学用语和相关文字从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是__________。
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,碳酸根的浓度约为c(CO32-)=____mol/L。(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)。碳酸钙饱和溶液中的离子浓度由大到小排序___________。
【答案】CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1 AC 1 减小 Al3+ +3H2O![]() 3Al(OH)3+3H+、CaCO3(s)
3Al(OH)3+3H+、CaCO3(s)![]() Ca2+(aq)+CO32-(aq),水解产生的H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 4.7×10-5 c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
Ca2+(aq)+CO32-(aq),水解产生的H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 4.7×10-5 c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
【解析】
(1)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJmol-1;②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJmol-1;③H2O(g)═H2O(l);△H=-44.0kJmol-1;根据盖斯定律:①+![]() ×②+2×③得CH3OH(l)+
×②+2×③得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l),由此计算△H;
O2(g)=CO2(g)+2H2O(l),由此计算△H;
(2)根据化学平衡状态特征分析;
(3)t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍,结合三行计算列式计算,气体压强之比等于气体物质的量之比,平衡常数K=![]() ,再向该容器中加入0.5molCO2和1molH2O,计算此时浓度商和平衡常数比较判断反应进行的方向;
,再向该容器中加入0.5molCO2和1molH2O,计算此时浓度商和平衡常数比较判断反应进行的方向;
(4)AlCl3溶液水解显酸性,结合CaCO3的溶解平衡分析可得;
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,由可知CaCO3(s)Ca2+(aq)+CO32-(aq),且CO32-+H2OHCO3-+OH-,水解Kh=![]() ,以此计算c(CO32-),溶液中c(Ca2+)=c(CO32-)+c(HCO3-);在碳酸钙饱和溶液中存在CO32-的分步水解,且一级水解程度大于二级水解,由此确定离子浓度的大小。
,以此计算c(CO32-),溶液中c(Ca2+)=c(CO32-)+c(HCO3-);在碳酸钙饱和溶液中存在CO32-的分步水解,且一级水解程度大于二级水解,由此确定离子浓度的大小。
(1)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJmol-1;②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJmol-1;③H2O(g)═H2O(l);△H=-44.0kJmol-1;根据盖斯定律:①+![]() ×②+2×③得CH3OH(l)+
×②+2×③得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O,则△H=(-359.8kJmol-1)+
O2(g)=CO2(g)+2H2O,则△H=(-359.8kJmol-1)+![]() ×(-556.0kJmol-1)+2×(-44.0kJmol-1)=-725.8 kJmol-1,故甲醇燃烧热的热化学方程式为CH3OH(l)+
×(-556.0kJmol-1)+2×(-44.0kJmol-1)=-725.8 kJmol-1,故甲醇燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O △H=-725.8 kJmol-1;
O2(g)=CO2(g)+2H2O △H=-725.8 kJmol-1;
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)CO2(g)+CO(g)+H2O(g);A.反应气体增多,开始压强增大,平衡时,压强不再变化,故A正确;
B.只有生成物为气体,CO2(g)的体积分数保持占![]() ,故B错误;
,故B错误;
C.根据ρ=![]() ,V不变,气体的质量增大,混合气体的密度不再变化,反应达到平衡,故C正确;
,V不变,气体的质量增大,混合气体的密度不再变化,反应达到平衡,故C正确;
D.只有生成物为气体,根据质量守恒定律,混合气体的平均摩尔质量始终等于草酸的摩尔质量,故D错误;
故答案为AC;
(3)t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,结合三行计算列式计算,设反应的二氧化碳为x;
2NH3(g)+CO2(g)CO(NH)2(s)+H2O(g)
起始量(mol) 3 1 0
变化量(mol) 2x x x
平衡量(mol)3-2x 1-x x
气体压强之比等于气体物质的量之比,容器内压强为开始时的0.75倍,3-2x+1-x+x=(3+1)×0.75,解得:x=0.5mol,则反应的平衡常数K=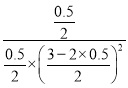 =1;
=1;
再向该容器中加入0.5molCO2和1molH2O,浓度商Qc=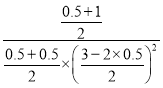 =1.5>K=1,平衡逆向进行,NH3的转化率将减小;
=1.5>K=1,平衡逆向进行,NH3的转化率将减小;
(4)CaCO3在溶液中有溶解平衡:CaCO3(s)Ca2+(aq)+CO32-(aq),Al3+ 水解显酸性,存在的水解反应式为Al3+ +3H2O![]() 3Al(OH)3+3H+,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解,故AlCl3溶液可以溶解CaCO3固体;
3Al(OH)3+3H+,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解,故AlCl3溶液可以溶解CaCO3固体;
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,则c(OH-)=10-4mol/L,溶液中有:CaCO3(s)Ca2+(aq)+CO32-(aq),且CO32-+H2OHCO3-+OH-,则c(HCO3-)=c(OH-)=10-4mol/L,水解Kh=![]() =
=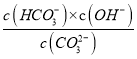 ,即
,即![]() =
= ,则c(CO32-)=4.7×10-5mol/L;在碳酸钙饱和溶液中存在溶解平衡CaCO3(s)Ca2+(aq)+CO32-(aq)和CO32-的分步水解,且一级水解程度大于二级水解,结合溶液显碱性,可知碳酸钙饱和溶液中的离子浓度由大到小排序c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。
,则c(CO32-)=4.7×10-5mol/L;在碳酸钙饱和溶液中存在溶解平衡CaCO3(s)Ca2+(aq)+CO32-(aq)和CO32-的分步水解,且一级水解程度大于二级水解,结合溶液显碱性,可知碳酸钙饱和溶液中的离子浓度由大到小排序c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】随着老百姓生活水平的提高,汽车进入寻常百姓家,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
A.氧化剂与还原剂的物质的量之比为5:1B.N2既是氧化产物也是还原产物
C.NaN3是氧化剂D.KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
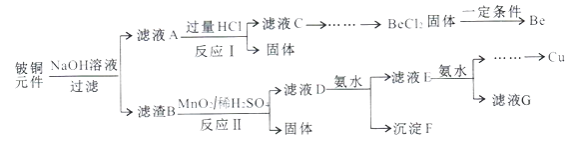
已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有___________(填化学式);写出反应I中含铍化合物与过量盐酸反应的离子方程式:___________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是___________;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是___________。
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为___________。
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是________(填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:![]()
![]()
![]()
![]() 尾气处理
尾气处理
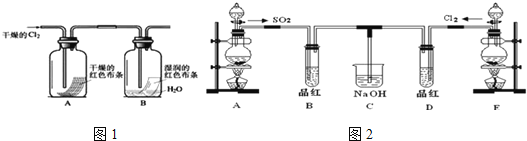
(1)写出实验室制取Cl2的离子方程式______________________,NA表示阿伏加德罗常数,若有4mol的HCl参加反应,则转移的电子总数为___________;
(2)现有以下3种试剂:A.饱和食盐水 B.浓硫酸 C.NaOH溶液
请在以上试剂中选择并回答填空:
X溶液应选用_________(填写序号);Y试剂的作用____________________.
(3)某化学兴趣小组为了探究Cl2的相关性质,设计了如图1的实验.
通入Cl2后,从观察集气瓶A、B中的现象可得出的结论是_____________(写出化学反应方程式,并用简要文字解释).
(4)某兴趣小组的同学为探究和比较SO2和氯水的漂白性,设计了如图2的实验装置.
①实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:______________________;
②反应开始一段时间后,观察到B、D两试管中的品红溶液都出现褪色的现象,但两者褪色原理不同,如何区别,请你帮助设计实验,你的操作是_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 在该温度下,0.05mol/L的Ba(OH)2溶液的pH=________;
(2)在NaHS溶液中物料守恒:_________
(3)将AgCl分别放入:①5 mL水②40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和③10mL0.1 mol·L-1 MgCl2溶液④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_________(用字母表示)。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最适宜采用的是________(填选项字母)
A.KMnO4 B.H2O2 C.氯水 D.HNO3
(5)如图所示,是原电池的装置图。请回答:
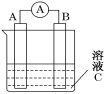
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;反应进行一段时间后溶液C的pH将________(填“变大”、“变小”或“基本不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为铝土矿(主要含Fe3O4、Al2O3、SiO2)提取铝的流程,以下说法正确的是( )
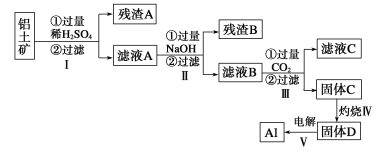
A.残渣A主要是H2SiO3B.滤液A中只存在Fe3+和Al3+
C.过程Ⅲ可以用HCl替代二氧化碳。D.滤液C主要是碳酸氢钠和硫酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域。已知:二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法正确的是( )
A. 二茂铁属于离子晶体
B. 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中碳环上有2个π键和5个σ键
,则其中碳环上有2个π键和5个σ键
D. 二价铁离子的基态电子排布式为:[Ar]3d44s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com