
【题目】二茂铁[(C5H5)2Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域。已知:二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法正确的是( )
A. 二茂铁属于离子晶体
B. 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中碳环上有2个π键和5个σ键
,则其中碳环上有2个π键和5个σ键
D. 二价铁离子的基态电子排布式为:[Ar]3d44s2
【答案】C
【解析】
A. 熔沸点较低的晶体一般为分子晶体;
B. 含有孤电子对和空轨道的原子之间易形成配位键;
C. 依据共价键存在形式作答;
D. 根据构造原理写出其核外电子排布式。
A. 依据题意,二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂,熔沸点较低的晶体一般为分子晶体,所以可推断二茂铁晶体为分子晶体,A项错误;
B. 碳原子含有孤电子对,铁含有空轨道,所以碳原子和铁原子之间形成配位键,B项错误;
C. 共价双键中含1个π键和1个σ键,共价单键中含1个σ键,则根据环戊二烯的结构式可知,碳环上有2个π键和5个σ键,C项正确;
D. 铁的原子序数是26,其核外电子数是26,铁原子失2个电子生成亚铁离子,根据构造原理知亚铁离子的核外电子排布式为:[Ar]3d6,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式______________。
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化 D.混合气体的平均摩尔质量保持不变
(3)合成尿素的反应为 2NH3(g) + CO2(g) =CO(NH2)2(s) + H2O(g)。t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。则t℃时的化学平衡常数为_____,若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将_____(填“增大”、“减小”或“不变”)。
(4)用化学用语和相关文字从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是__________。
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,碳酸根的浓度约为c(CO32-)=____mol/L。(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)。碳酸钙饱和溶液中的离子浓度由大到小排序___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP
500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.H2SO4的摩尔质量为98g
B.该硫酸的物质的量浓度为9.2mol·L-1
C.配制250mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_________ 。
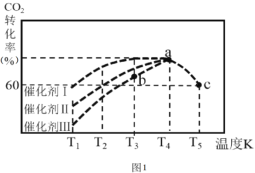
②一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:催化剂效果最佳的是催化剂______ (填“I、Ⅱ、Ⅲ)。b点v(正) ____v(逆) (填>、< 、=)。此反应在a点时已达平衡状态, a点的转化率比c点高的原因是_______。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
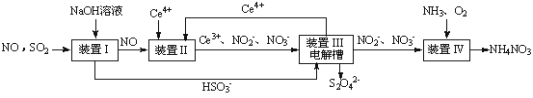
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2∶1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气__________L(用含a代数式表示,结果保留整数,否则不给分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的HCl气体8.96L溶于水形成100ml溶液,然后与足量的铁屑充分反应。计算:
(1)所得盐酸的物质的量浓度_______
(2)标准状况下生成H2的体积_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
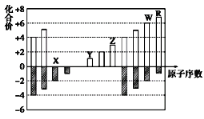
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
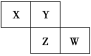
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
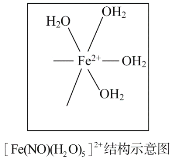
【题目】臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx也可在其他条件下被还原为N2。
(1)Fe3+基态核外电子排布式为__________________。
(2)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(3)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
(4)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
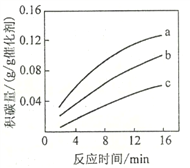
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com