
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 在该温度下,0.05mol/L的Ba(OH)2溶液的pH=________;
(2)在NaHS溶液中物料守恒:_________
(3)将AgCl分别放入:①5 mL水②40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和③10mL0.1 mol·L-1 MgCl2溶液④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_________(用字母表示)。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最适宜采用的是________(填选项字母)
A.KMnO4 B.H2O2 C.氯水 D.HNO3
(5)如图所示,是原电池的装置图。请回答:
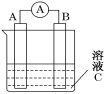
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;反应进行一段时间后溶液C的pH将________(填“变大”、“变小”或“基本不变”)。
【答案】11 c(Na+)=c(H2S)+c(HS-)+c(S2-) a>c>b>d B 2H++2e-=H2↑ 变大
【解析】
(1)依据由水电离的氢离子与氢氧根离子浓度相等先计算出该温度下水的离子积常数,再根据水溶液中KW=c(H+)×c(OH)求得结果;
(2)物料守恒是指溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和。也就是元素守恒(原子守恒),变化前后某种元素的原子个数守恒不变,据此分析;
(3)AgCl在溶液中存在溶解平衡AgCl(s) ![]() Cl-(aq)+Ag+(aq),依据氯离子浓度对沉淀溶解平衡的影响效果作答;
Cl-(aq)+Ag+(aq),依据氯离子浓度对沉淀溶解平衡的影响效果作答;
(4)根据除杂原则作答;
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则此时溶液中的c(OH-)=1×10-6 mol·L-1,所以水的离子积常数 KW=c(H+)×c(OH)=1×10-12,该温度下,0.05mol/L的Ba(OH)2溶液中c (OH-)=0.05mol/L×2=0.1mol/L,则c(H+)=![]() =
=![]() ,则pH=-lgc(H+)=11,
,则pH=-lgc(H+)=11,
故答案为:11;
(2)NaHS溶液中物料守恒式为:c(Na+)=c(H2S)+c(HS-)+c(S2-),
故答案为:c(Na+)=c(H2S)+c(HS-)+c(S2-);
(3)②③④中氯离子的浓度分别是0.3mol/L、0.2 mol/L、0.5 mol/L,四种水溶液中存在沉淀溶解平衡为:AgCl(s) ![]() Cl-(aq)+Ag+(aq),氯离子浓度越大,Ag+的浓度就越小,各溶液中Ag+的浓度从大到小顺序是a>c>b>d,
Cl-(aq)+Ag+(aq),氯离子浓度越大,Ag+的浓度就越小,各溶液中Ag+的浓度从大到小顺序是a>c>b>d,
故答案为:a>c>b>d;
(4)除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,但不能引入新杂质,
A. 引入K+和Mn2+,A项错误;
B. 过氧化氢是绿色氧化剂,本身不稳定,受热易分解,B项正确。
C. 引入Cl-,C项错误;
D. 引入NO3-,D项错误;
故答案为:B;
(5)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;溶液中氢离子放电,导致溶液中氢离子浓度减小,pH值变大,
故答案为:2H++2e-=H2↑;变大。


科目:高中化学 来源: 题型:
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是

①铜为负极,锌为正极;②铜极上有气泡;③SO42-向铜极移动;④锌发生还原反应;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-=Zn2+
A. ①②B. ①④⑥
C. ②④⑥D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
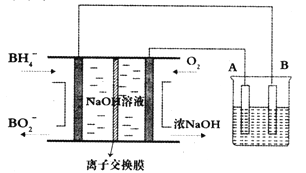
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O
C. 电解池中的电解质溶液可以选择CuSO4溶液
D. 每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式______________。
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化 D.混合气体的平均摩尔质量保持不变
(3)合成尿素的反应为 2NH3(g) + CO2(g) =CO(NH2)2(s) + H2O(g)。t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。则t℃时的化学平衡常数为_____,若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将_____(填“增大”、“减小”或“不变”)。
(4)用化学用语和相关文字从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是__________。
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,碳酸根的浓度约为c(CO32-)=____mol/L。(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)。碳酸钙饱和溶液中的离子浓度由大到小排序___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
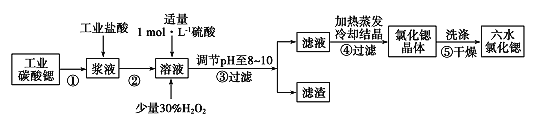
请回答:
(1)常温下,氯化锶溶液pH____7(已知金属性Ca<Sr)(填“大于”、“等于”或“小于”);
(2)写出在浆液中加入盐酸时主要发生的离子方程式________;
(3)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(4)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(5)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知32gA与40gB恰好完全反应,生成mgC和9gD。在相同条件下,16gA和30gB混合反应生成0.25molC及若干摩尔D,则物质C的摩尔质量应是( )
A.63g/molB.122g/molC.126g/molD.163g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用二氧化锰与浓盐酸反应制取纯净、干燥的氯气,装置如下图所示:
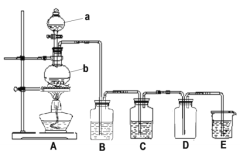
请回答下列问题:
(1)a装置的名称___________________________;
(2)收集氯气的方法为___________________________;
(3)烧瓶中发生反应的化学方程式为______________________;
(4)装置B中饱和食盐水的作用是_____________,装置E的作用是_________________;
(5)取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。则参加反应的二氧化锰的质量为______,参加反应的HCl的物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
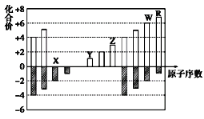
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com