
【题目】随着老百姓生活水平的提高,汽车进入寻常百姓家,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
A.氧化剂与还原剂的物质的量之比为5:1B.N2既是氧化产物也是还原产物
C.NaN3是氧化剂D.KNO3发生氧化反应
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
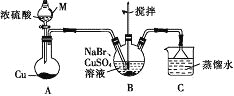
(1)仪器M的名称是________。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为______(填化学式)。
(3)B中发生反应的化学方程式为_______,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是_______(填标号)。
a.液溴 b.Na2SO4 c.铁粉 d.Na2S2O3
(4)下列关于过滤的叙述不正确的是_______ (填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁
b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是_______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是进行科学探究的重要途径,观察下图的实验装置,回答下面的问题。
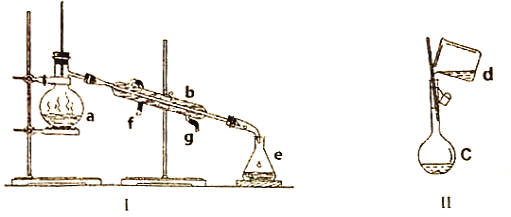
(1)写出下列仪器的名称:a:________________,b:________________,c:_________________。
(2)仪器c在使用前必须进行的操作是____________________________________________________。
(3)若用装置I制取少量蒸馏水,实验时a中除加入自来水外,还需加入_________________________,其作用是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_____。
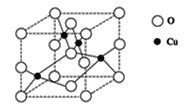
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
(4)Cu2O的熔点比Cu2S的_________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】再生铅行业是我国在重视环境保护和充分利用有色金属再生资源的情况下逐步发展起来的新兴产业。从废旧铅蓄电池中回收铅的工艺为:
![]()
电解原理如图所示。下列说法正确的是
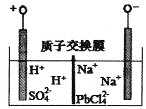
A. 阴极区电极反应式为:2H++2e-=H2↑
B. 电解过程中阳极附近pH明显增大
C. Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
D. 电路中流经4mol电子,阴极可得207g铅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A、B是金属单质,E、K是非金属单质,其它为化合物,F、G、H、I、J 焰色反应均为黄色,在这些物质中只有C、K是气体,其中K是黄绿色气体,反应⑧⑨是工业由H制I的重要反应。
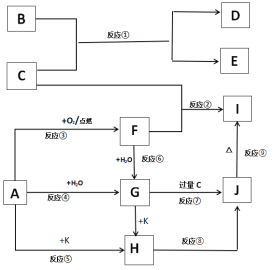
填写下列空白:
(1)写出化学式:B___,F___。
(2)写出反应①的化学反应方程式:____。
(3)写出反应⑦离子反应方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下四种物质:①22g二氧化碳②8g氢气③1.204×1024个氮气分子④4℃时18mL水它们所含分子数最多的是_______,所含原子数最多的______,质量最大的是_____所含电子数最多的是__________(填序号)
(2)12.4 gNa2R含Na+0.4mol,则Na2R的摩尔质量为__________,R的相对原子质量为__________,含R的质量为1.6g的Na2R,其物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式______________。
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化 D.混合气体的平均摩尔质量保持不变
(3)合成尿素的反应为 2NH3(g) + CO2(g) =CO(NH2)2(s) + H2O(g)。t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。则t℃时的化学平衡常数为_____,若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将_____(填“增大”、“减小”或“不变”)。
(4)用化学用语和相关文字从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是__________。
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,碳酸根的浓度约为c(CO32-)=____mol/L。(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)。碳酸钙饱和溶液中的离子浓度由大到小排序___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com