
【题目】亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:

已知:
室温下,①2NO+Na2O2===2NaNO2
②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是________________________________________。
(2)装置B中观察到的主要现象为________________________________________,发生反应离子方程式是_____________。
(3)装置D的作用是______________________________,发生反应的离子方程式是________________________________________。
(4)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和__________(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为__________(写名称)。
(5)利用改进后的装置将3.12gNa2O2完全转化为NaNO2,理论上至少需要木炭__________g
【答案】排尽空气,防止生成的NO被O2氧化 红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 利用酸性高锰酸钾溶液溶液氧化未反应的NO,可以防止污染空气 3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O NaOH; 碱石灰 0.48g
【解析】
A装置为C与HNO3(浓)反应生成二氧化碳与二氧化氮,二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成NO,C装置中制备NaNO2,由于二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,故需要需要除去二氧化碳,并干燥NO气体,可以在B、C之间添加成分碱石灰的装置,反应开始需要排尽装置中的空气,防止氧气将NO氧化,利用酸性高锰酸钾溶液溶液氧化未反应的NO,可以防止污染空气,由题目信息,酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+;
(5)根据方程式:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,3NO2+H2O=2HNO3+NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+Na2O2═2NaNO2进行计算,需找B装置中得到NO与C物质的量关系。
CO2↑+4NO2↑+2H2O,3NO2+H2O=2HNO3+NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+Na2O2═2NaNO2进行计算,需找B装置中得到NO与C物质的量关系。
A装置为C与HNO3(浓)反应生成二氧化碳与二氧化氮,二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成NO,C装置中制备NaNO2,由于二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,故需要需要除去二氧化碳,并干燥NO气体,可以在B、C之间添加成分碱石灰的装置,反应开始需要排尽装置中的空气,防止氧气将NO氧化.利用酸性高锰酸钾溶液溶液氧化未反应的NO,可以防止污染空气,验证NO的还原性.
(1)利用N2排尽空气,防止生成的NO被O2氧化;
(2)二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成硝酸铜与NO,观察到的现象为:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)由题目信息,酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+,故装置D的作用是利用酸性高锰酸钾溶液溶液氧化未反应的NO,可以防止污染空气;反应离子方程式为:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
(4)二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,可以在B、C之间添加成分碱石灰的装置,吸收除去二氧化碳,并干燥NO气体,故答案为:NaOH;碱石灰;
(5)n(Na2O2)=![]() =0.04mol,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠反应需要0.08molNO,设参加反应的碳为 nmol,根据C+4HNO3(浓)
=0.04mol,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠反应需要0.08molNO,设参加反应的碳为 nmol,根据C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O知,生成4nmolNO2,根据3NO2+H2O=2HNO3+NO,可知4nmolNO2与水反应生成4nmol×
CO2↑+4NO2↑+2H2O知,生成4nmolNO2,根据3NO2+H2O=2HNO3+NO,可知4nmolNO2与水反应生成4nmol×![]() =
=![]() nmol硝酸和
nmol硝酸和![]() nmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为
nmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为![]() nmol×
nmol×![]() =
=![]() nmol,所以
nmol,所以![]() nmol+
nmol+![]() nmol=2nmol=0.08mol,可得n=0.04mol,则需要碳的质量=12g/mol×0.04mol=0.48g。
nmol=2nmol=0.08mol,可得n=0.04mol,则需要碳的质量=12g/mol×0.04mol=0.48g。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的量的叙述不正确的是( )
A.物质的量是国际单位制中七个基本物理量之一
B.物质的量是表示物质所含微观粒子多少的一个物理量
C.物质的量常用符号n表示,其单位是摩尔(mol)
D.物质的量可用来表示物质的质量和数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国劳伦斯·利弗摩尔国家实验室(LLNL)设计的以熔融的碳酸盐为电解液,泡沫镍为电极,氧化纤维布为隔膜的直接碳燃料电池结构如图所示,下列说法错误的是( )
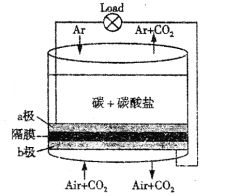
A. a极通气的目的是增强导电能力
B. a极的电极反应式为C+2CO32--4e-=3CO2↑
C. 电流由b极沿导线经负载再流向a极
D. CO32-由b极区透过隔膜流向a极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
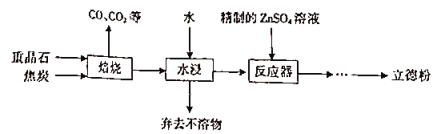
(1)焙烧(温度为1000~2000)时,焦炭需过量,其目的是____________________。
(2)焙烧过程中发生的反应之一是4CO+BaSO4![]() BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
(3)反应器中发生反应的化学方程式为______________________。
(4)流程中所需的精制的ZnsO,溶液的制取方法是:首先用工业级氧化锌(含少量FeO和Fe2O3杂质)和稀硫酸反应制取粗硫酸锌溶液,然后向粗硫酸锌溶液中先后加入H2O2溶液和碳酸锌精制。
①加入H2O2溶液时发生反应的离子方程式为______________________。
②加入碳酸锌的目的是________________,反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中进行以下反应:4NH3+5O2=4NO+6H2O,半分钟后冷却至室温,测得NO的物质的量增加了0.3mol,则此反应的平均反应速率υ(X)为( )
A. υ(H2O)=0.12mol·L-1·min-1B. υ(O2)=0.30mol·L-1·min-1
C. υ(NO)=0.008mol·L-1·s-1D. υ(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
A. H3 PO2属于三元酸 B. H3 PO2的结构式为
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com