
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | / | +3 | +4 | +5 | +7 | +1 | +5 | / |
| 最低价态 | / | / | -2 | / | -4 | -3 | -1 | / | -3 | -1 |
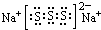 ,
,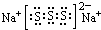 .
.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、37Cl与39K具有相同的中子数 | ||
| B、O22-与S2-具有相同的质子数和电子数 | ||
| C、H3O+与OH-具有相同的质子数和电子数 | ||
D、第114号元素的一种核素
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应将O3转变为O2 |
| B、Cl原子是总反应的催化剂 |
| C、氟氯甲烷是总反应的催化剂 |
| D、Cl原子反复起分解O3的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸能起氧化作用,无氧酸则不能 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、由X变为X2+的反应是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其中钇、铁的化合价均为+3价 |
| B、其中钇铁的化合价均为+2、+3价 |
| C、可表示为3YO3?3FeO?Fe2O3 |
| D、可表示为Y3O5?3Fe3O4?Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢铵 | B、硝酸铵 |
| C、氯化铵 | D、磷酸氢二铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).
高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com