
| A. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| B. | NaAlO2溶液中通入少量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO2-+H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4OH-═AlO2-+H2O |
分析 A.氢氧化铝为两性氢氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水;
B.二氧化碳少量,反应生成氢氧化铝沉淀和碳酸根离子;
C.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
D.一水合氨为弱碱,反应生成氢氧化铝沉淀,且一水合氨不能拆开.
解答 解:A.Al(OH)3溶于NaOH溶液中,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故A正确;
B.NaAlO2溶液中通入少量的CO2,反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故B正确;
C.Al2O3粉末溶于NaOH溶液中,反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故C正确;
D.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,试题侧重考查铝的化合物性质,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
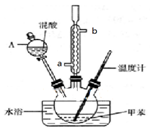 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):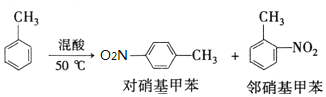
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃和卤代烃都不溶于水,且密度比水小 | |
| B. | 沸点由高到低顺序为CH3CH2CH2Br>CH3CH2Br>CH3CH2Cl>CH3CH3 | |
| C. | CH3Cl、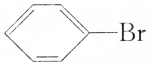 、CH3CH2Br都能发生水解反应和消去反应 、CH3CH2Br都能发生水解反应和消去反应 | |
| D. | CH3CH2I与酸化的AgNO3溶液反应会产生黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
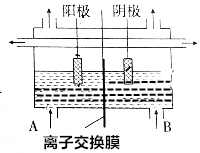 工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.
工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属阳离子的氧化性:Y>X | |
| B. | X、Y用导线连接后插入浓硝酸中,X溶解 | |
| C. | X、Y用导线连接后插人稀盐酸中,Y的表面有气泡产生 | |
| D. | X、Y用导线连接后插入氢氧化钠溶液中,X极为电子流出的一极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com