
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cs显+3价 | |
| B. | CsICl2溶于水,电离生成:Cs+、I-、Cl- | |
| C. | 酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
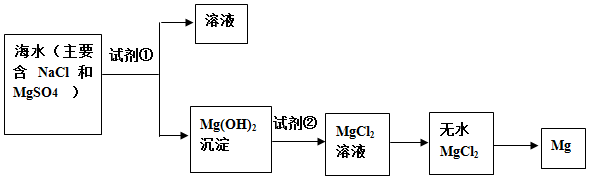
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )| A. | Y、Z元素形成的化合物中可能含有共价键 | |
| B. | 原子半径;Y<Z<W | |
| C. | 常温下s溶液的pH<7 | |
| D. | s与过量盐酸反应只生成一种正盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| B. | NaAlO2溶液中通入少量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO2-+H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往碳酸钙溶液中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 向次氯酸钙溶液通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| C. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com