
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:___________________________。
(2)图2中,钢闸门C作________极。若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为_____________________________________,检测该电极反应产物的方法是_________________________________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________极(填“正”或“负”)。F电极上的电极反应式为_______________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因:___________________________________________________。
(4)乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_____________________________________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________ mol。
【答案】 b 锌等作原电池的负极,(失电子,Zn-2e-===Zn2+)不断遭受腐蚀,需定期拆换 阴 2Cl--2e-===Cl2↑ 将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气(或取阳极附近溶液滴加淀粉KI溶液,变蓝) 负 ClO-+2e-+H2O===Cl-+2OH- Mg+2H2O===Mg(OH)2+H2↑ HOOC—COOH+2e-+2H+===HOOC—CHO+H2O 2
【解析】试题分析:(1)根据电化学原理,材料B对应的金属的活泼性应强于被保护的金属。B作负极,发生氧化反应被腐蚀;(2)图2为外加电流的阴极保护法,被保护的金属应与电源负极相连, D作阳极,Cl-在阳极发生失电子反应生成Cl2。(3)①由图示可知Mg转化为Mg(OH)2,发生失电子的氧化反应。由图示可知在F电极(正极)ClO-转化为Cl-。②镁可与水缓慢反应生成氢气。(4)①由H+的迁移方向可知N为阴极,发生得电子的还原反应,结合题意“两极室均可产生乙醛酸”,可知N电极为乙二酸发生得电子的还原反应生成乙醛酸。②阴极2 mol H+反应生成1 mol乙醛酸和1 mol H2O,在阳极产生的1 mol Cl2能将1 mol乙二醛氧化成1 mol乙醛酸。
解析:根据电化学原理,材料B对应的金属的活泼性应强于被保护的金属,所以材料B可以为锌板,选b;锌等作原电池的负极,(失电子,Zn-2e-===Zn2+)不断遭受腐蚀,需定期拆换;(2)图2为外加电流的阴极保护法,被保护的金属应与电源负极相连,作阴极,则D作阳极,Cl-在阳极发生失电子反应生成Cl2。将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气。(3)①由图示可知Mg转化为Mg(OH)2,发生失电子的氧化反应,故E为负极。由图示可知在F电极(正极)ClO-转化为Cl-,发生得电子的还原反应,电极反应为ClO-+2e-+H2O===Cl-+2OH-。②镁可与水缓慢反应生成氢气,即发生自腐蚀现象,反应方程式为Mg+2H2O===Mg(OH)2+H2↑。(4)①由H+的迁移方向可知N为阴极,发生得电子的还原反应,结合题意“两极室均可产生乙醛酸”,可知N电极为乙二酸发生得电子的还原反应生成乙醛酸,电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O。②1 mol乙二酸在阴极得到2 mol电子,与2 mol H+反应生成1 mol乙醛酸和1 mol H2O,同时在阳极产生的1 mol Cl2能将1 mol乙二醛氧化成1 mol乙醛酸,两极共产生2 mol乙醛酸。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列变化中,需加氧化剂才能实现的是
A. Cl2 →NaClO B. H2O2 → O2 C. (NH4)2SO4 →N2 D. CaO→CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该有机物 HOCH2—CH2—CH=CHBr 能发生以下反应中的( )种。
①与 AgNO3 溶液生成淡黄色沉淀 ②加聚反应 ③消去反应 ④使酸性 KMnO4 溶液褪色 ⑤取代反应 ⑥使溴水褪色 ⑦催化氧化反应
A.4B.5C.6D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧时耗O2的量不变的是
A. 甲烷、甲醇、甲醛 B. 丙烯酸(CH2=CH-COOH)、乙烯、乙醇
C. 丙烯、2-丁烯、环已烷 D. 乙炔、苯、1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
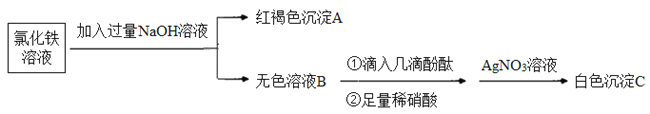
①写出生成A的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液B与稀硝酸发生了离子反应?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 生石灰能与水反应,可用于实验室干燥氯气
B. NO2、、SO2二种气体都能与水反应生成酸,它们都是酸性氧化物
C. SO2、NOx的大量排放会导致酸雨的发生
D. 高温下,二氧化硅与碳酸钠反应放出CO2,可说明硅酸的酸性比碳酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 分子数为NA的CO和C2H4混合气体的体积约为22.4 L
B. 标准状况下,4.48 L水中含有的氢原子数为0.2 NA
C. 电解水制取H2和O2时,每生成1 mol O2就生成2 NA个H2分子
D. 0.1 L 3.0 mol·L-1的KNO3溶液中含有K+的数目为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com