
【题目】在一定条件下,反应N2+3H2![]() 2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1 mol,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1 mol,则反应速率为
A.v(H2)=0.03mol/(Lmin) B.v(N2)=0.02mol/(Lmin)
C.v(NH3)=0.17mol/(Lmin) D.v(NH3)=0.01mol/(Lmin)
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,且XY2为常见元素形成的离子化合物,则X、Y在元素周期表中的位置分别为______、_________,用电子式表示该化合物形成过程_____________。
(2)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是____。
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子_____(填“是”或“不是”)都满足最外层为8电子结构。
(3)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。请填空:
①Y、Z和W三种元素是否位于同一周期(填“是”或“否”):________,理由是________
②X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1。写出该化合物的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者共存
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4溶液,当c(Cu2+)降至原来的一半时停止通电,则加入下面物质能使溶液恢复成原来浓度的是( )
A.无水CuSO4B.CuOC.Cu(OH)2D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g) + I2(g) ![]() 2HI(g) △H < 0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同温度下分别达到平衡。下列说法不正确的是( )
2HI(g) △H < 0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同温度下分别达到平衡。下列说法不正确的是( )
A. 乙中反应速率比甲中反应速率快
B. 平衡时甲、乙两容器中混合物的总物质的量之比为2:3
C. 若平衡时甲中H2的转化率为40%,则乙中H2的转化率大于40%
D. 平衡后,向乙中再加入0.1mol H2,建立新的平衡时,甲和乙中H2的百分含量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(s,单斜)![]() S(s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是______(填“S(单斜)”或“S(斜方)”)。
S(s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是______(填“S(单斜)”或“S(斜方)”)。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H—H | H—Cl |
键能 | 436 | 431 |
热化学方程式:H2(g) + Cl2(g) = 2HCl(g) ΔH=-183 kJ·mol-1,则Cl2的键能为____kJ·mol-1。
(3)标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:____________________________。
(4)已知:C(石墨,s)+ O2(g) = CO2(g) ΔH1=-a kJ·mol-1
H2(g) + 1/2O2(g) = H2O(l) ΔH2=-b kJ·mol-1
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为____kJ·mol-1 (用含a,b,c的式子表示)。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如图所示。下列说法正确的是
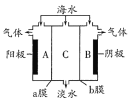
A. B极室产生的气体可使湿润的KI淀粉试纸变蓝
B. A极室产生氧气并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. b膜是阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com