
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是( )
A.Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
B.T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直
接由单质Y和T在低温下合成
【答案】A
【解析】
试题分析:Q是地壳中含量最高的元素,所以Q是O元素,R、Y原子的最外层电子数与电子层数相同,且R的原子序数小于O,若R是Be,符合最外层电子数与电子层数相同,但不符合R与T的核电荷数之和等于Q的核电荷数,所以R是H元素,则T是N元素,W与R同主族,则W是Na元素,所以Y是第三周期、第三主族元素Al。A、O与Na形成的两种常见化合物中含有的阴离子与阳离子的比例相同,都是12,都属于离子晶体,正确;B、N原子半径大于O原子半径,所以T、Q、W、Y的原子半径大小为:Q<T<Y<W,错误;C、Q与Y组成的常见物质是氧化铝,是两性氧化物,但含有离子键 ,错误;D、由Y和T组成的物质AlN是原子晶体,但不是由Al和氮气直接制取的,错误,答案选A。
考点:考查元素的推断,元素及其化合物的性质的判断


科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
A.CaO+H2O==Ca(OH)2 B.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
C.CaCO3 CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3- I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度 。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度 。
实验原理:
为了测定平衡时的c(I3-) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 = 2NaI + Na2S4O6。由于溶液中存在I3- I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1).用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2).将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3).分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4).带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因
是 。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是 。
③滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
④用c 、V1 和V2 表示c(I3-)为 mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
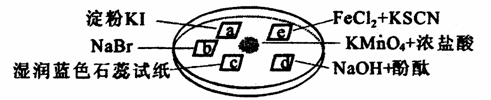
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2> |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色7 | 氯气与水生成了漂白性物质 |
| | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为0.1mol·L-1,)是
A.CaCl2和Na2CO3 B.稀盐酸和K2CO3 C.Ba(OH)2和NaHCO3 D.AgNO3和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,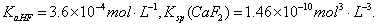 现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1mol·L-1HF 溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在给定的条件下一定能大量共存的是
A.pH=1的溶液中:Na+、 K+ 、MnO4- 、CO32-
B. 0. 1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl-
C. c(Fe3+) =0. 1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42-
D.室温下,水电离出的c(H+ )=1 ×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法正确的是
A.同温同压下,相同体积的任何气体单质所含的原子数目相同
B.1 mol过氧化钠中阴离子所带的负电荷数为2NA
C.常温常压下,11.2 L氮气所含的原子数目为NA
D.某温度时,pH=6的纯水中含10-6NA个OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com