
已知25℃时,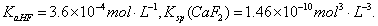 现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1mol·L-1HF 溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
科目:高中化学 来源: 题型:
下列条件下,两种气体所含的原子数一定相等的是( )
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中 Na2CO3质量分数的是
Na2CO3质量分数的是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是( )
A.Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
B.T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直
接由单质Y和T在低温下合成
查看答案和解析>>
科目:高中化学 来源: 题型:
类比法是化学学习过程中一种重要方法,以下类比关系正确的是
A.工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质
B.醇和酚中都有羟基,都可以和氢氧化钠溶液反应
C.二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应
D.氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如下图所示,则溶液中c(Cl¯)与c(SO42¯)之比为( )
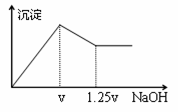
A.1∶1 B.2∶3 C.3∶2 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过
质谱法测得为56,它的核磁共振氢谱显示只有两组峰;D可以发生银镜反应,在催化
剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个—CH3。
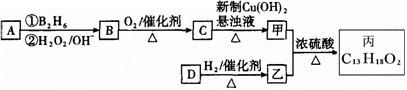

(1)A的结构简式为 ;乙的分子式为 。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是 ;D有多种同分异构体,其中与
其所含官能团相同的同分异构体有 种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为 。
(5)写出满足下列条件的有机物的结构简式
ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ苯环上有两个支链且苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸。检验CuO经氢气还原所得到红色产物中是否含有碱性氧化物Cu2O的试剂是 ,反应的离子方程式 。
Ⅲ.实验室有黄铜(铜和锌两种金属的混合物)粉末。课外化学兴趣小组欲利用给出的实验仪器及试剂,测定该样品中锌的质量分数。除托盘天平必用外,供选择的实验装置如下图所示:
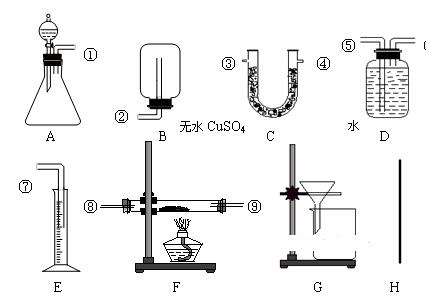
实验中可测得的数据:
黄铜的质量ag ; 充分反应后在标况下生成氢气的体积为bL
反应前仪器和药品的质量为c g ;充分反应后剩余固体的质量为d g
充分反应后仪器和药品的质量为e g
(1)实验中可供选择的药品除样品外,还有:①足量的浓硫酸、②足量的稀硫酸、③氧化铜。你认为一定要用到的药品是 (填序号)。
(2)甲同学实验中使用了A、D、E三种装置,组装时接口编号的连接顺序为 ,(填序号)写出合金中锌的质量分数的计算式 。
(3)乙同学实验中测得的数据为:黄铜的质量a g;充分反应后剩余固体的质量为d g。他在实验中使用了上图中 装置(填符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com