
对于易燃易爆有毒的化学物质,往往会在其包装上贴危险警告标签(如图所示),下面所列物质,贴错了包装标签的是( )
|
| A. |
| B. |
| C. |
| D. |
|
| 化学试剂的分类.. | |
| 专题: | 元素及其化合物;化学实验基本操作. |
| 分析: | 解答本题可根据浓硝酸、四氯化碳、白磷、黑火药等药品的性质与图中所示标志的含义进行分析判断即可. |
| 解答: | 解:A.浓硝酸有腐蚀性,属于腐蚀品,图为腐蚀品标志,故A正确; B.四氯化碳不支持燃烧,不燃烧,是一种高效灭火剂,灭火时,液态四氯化碳迅速转化为气态并覆盖在火焰上,图为易燃性标志错误,故B错误; C.白磷属于有毒物质,图中所示标志是有毒品标志,故C正确; D.黑火药属于易爆物,应贴爆炸品的标志,图为爆炸品标志,故D正确; 故选B. |
| 点评: | 本题考查危险品标志,难度不大,解这类题时,首先要知道各种物质的性质,然后根据各个标签所代表的含义进行分析判断. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3- I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度 。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度 。
实验原理:
为了测定平衡时的c(I3-) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 = 2NaI + Na2S4O6。由于溶液中存在I3- I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1).用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2).将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3).分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4).带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因
是 。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是 。
③滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
④用c 、V1 和V2 表示c(I3-)为 mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,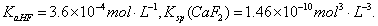 现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1mol·L-1HF 溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在给定的条件下一定能大量共存的是
A.pH=1的溶液中:Na+、 K+ 、MnO4- 、CO32-
B. 0. 1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl-
C. c(Fe3+) =0. 1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42-
D.室温下,水电离出的c(H+ )=1 ×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 =578kJ/mol,I2= 1817kJ/mol, I3= 2745kJ/mol,I4 =11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题。
(1)AY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在_________个σ键。
(2)X与NaOH溶液反应的离子方程式为___________。超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,晶体与金刚石类似,属于___________晶体.B的最简单氢化物容易液化,理由是___________。
(3)X、氧、B元素的电负性由大到小顺序为___________________(用元素符号作答)。
(4)Z的基态原子核外电子排布式为_____________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z十HCl十O2 = ZCI十HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是___________(填序号)。
①氧化剂是O2②HO2在碱中不能稳定存在③氧化产物是HO2, ④1 molZ参加反应有1 mol电子发生转移
已知Z的晶胞结构如下图所示,又知Z的密度为9.00g/cm3,则晶胞边长为______ ;ZYO4常作电镀液,其中YO42-的空间构型是____________ 。Y原子的杂化轨道类型是________。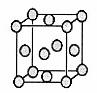
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的a L氨气溶于1L水中,得到氨水的密度为b g•cm﹣3,则该氨水的物质的量浓度为( )
|
| A. |
| B. |
|
|
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法正确的是
A.同温同压下,相同体积的任何气体单质所含的原子数目相同
B.1 mol过氧化钠中阴离子所带的负电荷数为2NA
C.常温常压下,11.2 L氮气所含的原子数目为NA
D.某温度时,pH=6的纯水中含10-6NA个OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.经测定某物质只含一种元素,则该物质一定是单质
B.阳离子、阴离子中均分别只含一种元素,则由这样的阴、阳离子组成的物质一定为纯净物
C.既能和酸反应又能和碱反应的化合物一定为两性化合物
D.酸性氧化物均可与强碱反应,碱性氧化物都是金属氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com