
同温同压下,等质量的下列气体所占有的体积最大的是( )
|
| A. | H2 | B. | CH4 | C. | CO2 | D. | SO2 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如下图所示,则溶液中c(Cl¯)与c(SO42¯)之比为( )
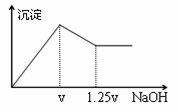
A.1∶1 B.2∶3 C.3∶2 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
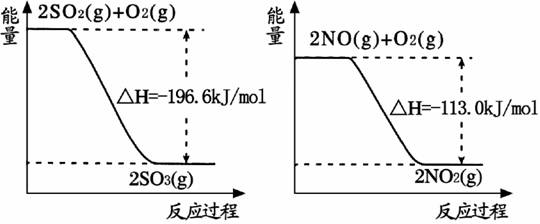 则NO2氧化SO4的热化学方程式为 。
则NO2氧化SO4的热化学方程式为 。
(2)在2L密闭容器中放入1 mol氨气,在一定温度进行如下反应:
2NH3(g)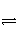
 N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
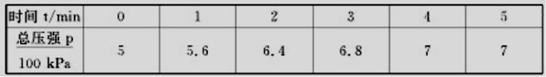
则平衡时氨气的转化率为 。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0. 2 mol电子时,生成气体在标准状况下的体积为 。联氨溶于水可以发生与氨水类似的电离,联氨在水溶液中的电离方程式为 (写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0. 1 mol/L氯化铵溶液由水电离出的氢离子浓度为1 X 10-5mol/L,则在该温度下此溶液中氨水的电离平衡常教Kb(NH3·H2O)= 。
(5)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,H2能将NO3-还原为N3,25℃时,反应进行10 min,溶液的pH由7变为12,则其平均反应速率v(NO3-)为 。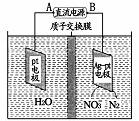
②电化学降解NO3-的原理如右图所示。若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右 )为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与50mL 1mol/L FeCl3溶液中Cl﹣物质的量浓度相等是( )
|
| A. | 100mL 1mol/L NaCl溶液 | B. | 75mL 1mol/L MgCl2溶液 |
|
| C. | 150mL 3mol/L KCl溶液 | D. | 25mL 2mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于气体的性质和组成:
(1)22g CO2的物质的量为 0.5mol ,该气体在标准状况下的体积为 11.2L ,其中含有氧原子的数目为 6.02×1023 .
(2)等质量CO、CO2两种气体的摩尔质量之比为 7:11 ;同温同压下的体积比为 11:7 ;其中氧元素的原子个数比为 11:14 ;
(3)在标准状况下,某CO、CO2混合气体,其中CO、CO2质量比7:22,现有体积为20.16L的该混合气体,其中二氧化碳的物质的量为 0.6mol .
(4)已知4g RO32﹣中核外电子数比质子数多6.02×1022个,则元素R的相对原子质量为 32 .
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化钠和氢化钠都是离子化合物,与水反应的方程式(未配平)如下:
Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述①离子半径:Na+>N3->H+;②与水的反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.②③④⑤ B.①③⑤ C.②④ D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
B.100 mL 1 mol·L-1 K2SO4溶液 中含有的钾离子数为0.1NA
中含有的钾离子数为0.1NA
C.10克氖气所含原子数约为6.02×1023
D.常温常压下,NA个H2分子的体积小于22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com