
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
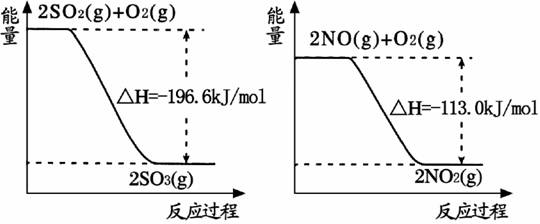 则NO2氧化SO4的热化学方程式为 。
则NO2氧化SO4的热化学方程式为 。
(2)在2L密闭容器中放入1 mol氨气,在一定温度进行如下反应:
2NH3(g)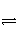
 N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
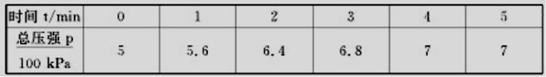
则平衡时氨气的转化率为 。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0. 2 mol电子时,生成气体在标准状况下的体积为 。联氨溶于水可以发生与氨水类似的电离,联氨在水溶液中的电离方程式为 (写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0. 1 mol/L氯化铵溶液由水电离出的氢离子浓度为1 X 10-5mol/L,则在该温度下此溶液中氨水的电离平衡常教Kb(NH3·H2O)= 。
(5)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,H2能将NO3-还原为N3,25℃时,反应进行10 min,溶液的pH由7变为12,则其平均反应速率v(NO3-)为 。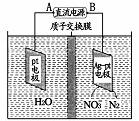
②电化学降解NO3-的原理如右图所示。若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右 )为 g。
【知识点】热化学方程式 化学平衡的计算F1F2G4
【答案解析】
(1)NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ•mol-1;
(2)40% (2分) (3) 1.12L (2分) N2H4+H2O=N2H5++OH- (2分)
Kb(NH3·H2O)=1X10-5mol/L (2分)
(5)①0.001mol/( L·min) (2分) ②14.4 (2分)
解析:(1)由图示得到以下两个方程式:
①2SO2(g)+O2(g)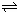 2SO3(g)△H=-196.6kJ•mol-1,
2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2(g)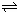 2NO2(g)△H=-113.0kJ•mol-1,
2NO2(g)△H=-113.0kJ•mol-1,
根据盖斯定律可知,(①−②)/2可得NO2(g)+SO2(g)═SO3(g)+NO(g),
则△H==-41.8kJ•mol-1,
(2)根据数据判断4分钟达到平衡,设氨气的转化率为a,利用压强之比等于物质的量之比计算;
2NH3 ⇌ N2 + 3H2 △n
2 1 3 2
a 0.5a 1.5a a
5/7=1/(1+a) 解得a=0.4,故氨气的转化率为40%;
(3)肼(N2H4)在空气中完全燃烧生成氮气和水,方程式为:
N2H4 +O2 =N2 +2H2O 转移电子数
22.4L 4 mol
V 0.2mol
V=1.12L;
肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-;
(4)NH4+在溶液中能发生水解反应,NH4++H2O⇌NH3•H2O+H+
故c(NH3•H2O)=c(H+)=1×10-5mol/L,则c(OH-)=Kw/c(H+)=10−14/10−5=10-9mol/L,
c(NH4+)=0.1mol/L,
氨水的电离方程式为:NH3•H2O⇌NH4++OH-
电离平衡常数Kb(NH3•H2O)=c(NH4+)×c(OH−)/c(NH3•H2O),
数据代入表达式:Kb(NH3•H2O)=0.1mol/L×10−9mol/L÷10−5mol/L=1×10-5mol/L;
①利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式为:2NO3-+5H2=N2+2OH-+4H2O,利用离子方程式知v(NO3-)=v(OH-)=(10−2−10−7)/10=0.001 mol/(L•min),
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g;
【思路点拨】本题考查了热化学方程式的书写,平衡转化率的计算,氧化还原反应的计算及电离平衡常数的计算,其中电离平衡常数计算较难.差量法是常用的计算方法,根据氧化还原反应计算时,可把转移电子数看作物质来根据方程式计算.(5)中②要注意该题中阴极室有氢离子进入,易漏掉,为易错点。
选考部分(包括3小题,每题15分,请考生从中选1道试题作答。)


科目:高中化学 来源: 题型:
在0.1mol·L一CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO一+ H+,对于该平衡,下列叙述不正确的是 ( )
CH3COO一+ H+,对于该平衡,下列叙述不正确的是 ( )
A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大
B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大
C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为0.1mol·L-1,)是
A.CaCl2和Na2CO3 B.稀盐酸和K2CO3 C.Ba(OH)2和NaHCO3 D.AgNO3和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为:N2+3H2  2NH3
2NH3
则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6 H2O (g)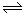 4NH3(g)+3O2(g) △H=Q ①
4NH3(g)+3O2(g) △H=Q ①
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3), 分别加 入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数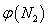 与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。

(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。
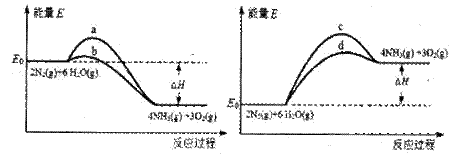
III.目前工业合成氨的原理是: N2(g)+3H2(g)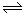 2NH3(g) △H=-93.0kJ/mol ②
2NH3(g) △H=-93.0kJ/mol ②
回答下列问题:
(1)结合II中的数据,则2H2(g)+ O2(g)=2 H2O (g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率
为 时,则起始时NH3的物质的量
时,则起始时NH3的物质的量 _________mol。
_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在给定的条件下一定能大量共存的是
A.pH=1的溶液中:Na+、 K+ 、MnO4- 、CO32-
B. 0. 1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl-
C. c(Fe3+) =0. 1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42-
D.室温下,水电离出的c(H+ )=1 ×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用到玻璃棒:①过滤;②蒸发;③溶解;④向容量瓶里转移液体,其中玻璃棒的作用相同的是( )
A.①和② B.①和③ C.③和④ D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.化学是在分子、原子水平上认识物质,了解化学可以改变分子、创造出新的分子
B.医疗上所用“钡餐”使用的是氯化钡
C.氮化硅陶瓷、通讯光缆等都是新型无机非金属材料
D.盐卤能使蛋白质变性,因此喝不得,但可以用盐卤做豆腐
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴根据分子中所含官能团可预测有机化合物的性质。
①下列化合物中能发生消去反应的是_____▲_____(填字母)。
a.CH3OH b.CH3CH2Cl c.CH3CH2OH d.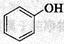
②下列化合物中,常温下易被空气氧化的是____▲_____(填字母)。
a.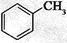 b.
b.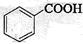 c.
c. d.
d.
⑵甲苯( )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
①甲苯分子中一定共平面的碳原子有____▲___个。
②甲苯苯环上的一溴代物有___▲___种,请写出其中一种的结构简式______▲____。
③除去苯中混有的少量甲苯,可选用的试剂是_______▲______。
⑶化合物C是一种医药中间体,可通过下列方法合成:
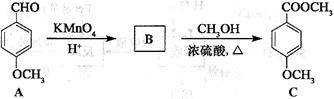
已知: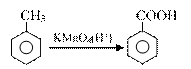 。
。
①A中含氧官能团的名称为______▲___和_____▲____。
②B的结构简式为_______▲_______。
③B→C的反应类型为____▲______。
④C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应,且1molD最多能与2molNaOH反应。D分子核磁共振氢谱(1HNMR)中有4种不同信号峰,请写出D的一种结构简式:_______▲_______。
⑤结合已知信息和所学知识,写出以对二甲苯和乙醇为原料,制备
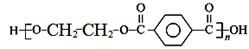 的合成路线流程图(无机试剂任用)。(5分)
的合成路线流程图(无机试剂任用)。(5分)
合成路线流程图示例如下:
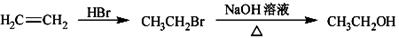
▲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com