
�˹��̵���ָ����Ԫ��������̬ת��Ϊ����̬�Ĺ��̡�
I�����һЩ��ѧ���о����ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�鵪�Ĺ̶�һ��ⷨ�ϳɰ����������˵�����������ת���ʡ�
�ܷ�ӦʽΪ��N2+3H2  2NH3
2NH3
���ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ��H2���ϵ�ͨ��_________����������������� ��
����һ�缫ͨ��N2���õ缫�ķ�ӦʽΪ__________________________��
II���ݱ�������һ�������£�N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ����Ҫ����ΪNH3��Ӧ�ķ�Ӧ����ʽΪ��2N2(g)+6 H2O (g)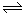 4NH3(g)+3O2(g) ��H��Q ��
4NH3(g)+3O2(g) ��H��Q ��
��1��������Ӧ��ƽ�ⳣ������ʽΪ_______________��
��2��ȡ��ݵ����N2��H2O�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3���� �ֱ�� �������ͬ�ĺ����ܱ������У����¶Ȳ���ͬ������·�����Ӧ����Ӧ��ͬʱ���õ������������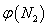 �뷴Ӧ�¶�T�Ĺ�ϵ��������ͼ��ʾ����������Ӧ��Q________0�����������������=������
�뷴Ӧ�¶�T�Ĺ�ϵ��������ͼ��ʾ����������Ӧ��Q________0�����������������=������

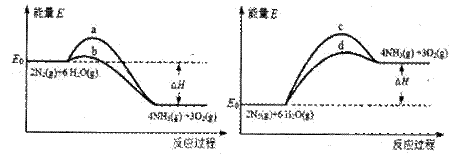
��3����������Ӧ���д���������·���������ͼ��ʾ��a��b��c��d���������У��ܱ�ʾ��Ӧ��ϵ�����仯����_______������ĸ���ţ���ͼ�С�H����ֵΪ1530kJ��mol-1��
III��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ� N2(g)+3H2(g)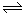 2NH3(g) ��H��-93.0kJ/mol ��
2NH3(g) ��H��-93.0kJ/mol ��
�ش��������⣺
��1�����II�е����ݣ���2H2(g)+ O2(g)=2 H2O (g)�ġ�H��___________��
��2����һ���¶��£���1molN2��3mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8mol��
�ٴ�ƽ��ʱ��H2��ת���� ______________��
______________��
������ͬ�����£�����ʼʱֻ��NH3���ڸ������У��ﵽƽ��״̬ʱNH3��ת����
Ϊ ʱ������ʼʱNH3�����ʵ���
ʱ������ʼʱNH3�����ʵ��� _________mol��
_________mol��
���𰸡���14�֣���. ����2�֣� N2��6H����6e��===2NH3 ��2�֣�
��.��1��K��c(NH3)4��c(O2)3/c(N2)2��c(H2O)6��2�֣�
��2������1�֣� ��3��d��1�֣�
��. ��1����572.0 kJ��mol��1��2�֣���λ��д�����֣�
��2����60%��2�֣� ��2��2�֣�
��������
���������I. �ڵ�ⷨ�ϳɰ��Ĺ����У���������������Ӧ������ͨ����ص���������һ��ͨ�뵪��������������ԭ��Ӧ�������������������ӽ�� �������缫��ӦʽΪN2��6H����6e��===2NH3��
II.��1������ƽ�ⳣ���ı���ʽ��֪�÷�Ӧ��ƽ�ⳣ��K= c(NH3)4��c(O2)3/c(N2)2��c(H2O)6��
��2��ͼ�����ߵ��ʾ��Ӧ�ﵽƽ��ʱ������������������¶����ߣ����������������С��˵�������¶�ƽ�������ƶ����������������ȷ�Ӧ������Q>0��
��3��2N2(g)+6 H2O (g)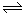 4NH3(g)+3O2(g) ��H��Q�����ȷ�Ӧ����Ӧ������������������������������ʹ�ô��������Խ��ͷ�Ӧ�Ļ�ܣ�����Ӧ�Ȳ��䣬����Ӧѡ��d���ߣ�
4NH3(g)+3O2(g) ��H��Q�����ȷ�Ӧ����Ӧ������������������������������ʹ�ô��������Խ��ͷ�Ӧ�Ļ�ܣ�����Ӧ�Ȳ��䣬����Ӧѡ��d���ߣ�
III.��1����II֪Q=+1530kJ/mol�����ݸ�˹���ɵ�����ʽ2H2(g)+ O2(g)=2 H2O (g)�ġ�H=���ڡ�2-�٣�/3=[(-93.0)��2-1530]kJ/mol/3=-572.0kJ/mol��
��2�����跴Ӧ��ƽ��ʱ���ĵ��������ʵ�����xmol����
N2(g)+3H2(g)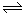 2NH3(g)
2NH3(g)
��ʼʱ��mol�� 1 3
ת���ģ�mol�� x 3x 2x
ƽ��ʱ��mol�� 1-x 3-3x 2x
����������1-x+3-3x+2x=2.8,����x=0.6mol����������ת���� 3x/3��100%=60%;
3x/3��100%=60%;
�ڵ���1+��2=1ʱ˵��ֻ��NH3���ڸ������У��ﵽƽ��״̬��ԭƽ���ǵ�Чƽ�⣬����������ȫ��ת��Ϊ���������ʵ������ɴﵽ��Чƽ�⣬����1mol������3mol������ȫת��Ϊ���������ʵ�����2mol.
���㣺����绯ѧԭ����Ӧ�ã���ѧƽ�����۵�Ӧ�ã�ƽ�ⳣ���ı�ʾ����Ӧ��ЧӦ���жϣ���˹���ɵ�Ӧ�ã���Чƽ����жϣ�ת���ʵļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ֪ʶ������������Ҫ���壬����˵������ȷ���� (����)
A����ľ�ң�����K2CO3��ˮ��Һ��������ϴ������
B���Ҵ�������ͼ�ȩ�㷺Ӧ����ʳƷ�ӹ�
C�������ŷŵ�CO2�ܽ��͵��������ЧӦ
D���ں������������п�飬�ɼ�������ĸ�ʴ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ���
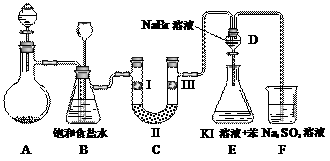
��1���Ʊ�����ѡ�õ�ҩƷΪ��Ư�۾������Ũ���ᣬ��صĻ�ѧ��Ӧ����ʽΪ��
��
��2��װ��B�б���ʳ��ˮ�������� ��ͬʱװ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е����� ��
��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C��I��II��III���η��� ��
| a | b | c | d | |
| I | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| II | ��ʯ�� | �轺 | Ũ���� | ��ˮ�Ȼ��� |
| III | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԡ�����D�л���ͨ����������ʱ�����Կ�����ɫ��Һ��Ϊ���غ�ɫ��˵���ȵķǽ����Դ����塣��������װ��D��������Һ����װ��E�У����۲쵽�������� �������� ����ܡ����ܡ���˵����ķǽ�����ǿ�ڵ⣬ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
SCR����ѡ���Դ���ԭ��������һ����NH3��Ϊ��ԭ������������NOx�ֽ�
������N2��H2O�ĸɷ�������������Ӧԭ��Ϊ����6NO+4NH3��5N2+6H2O��
��6NO2+8NH3��7N2+12H2O����NO+NO2+2NH3��2N2+3H2O����˵����ȷ���ǣ� ��
A��NOx��Ҫ��������β�����ŷţ�����������ЧӦ����Ҫ����֮һ
B��N2�Цм���Ҽ�֮��Ϊ12
C����Ӧ����ÿ����22.4LN2��ת�Ƶ�����1.5NA
D��NH3�ķе��PH3�ķе��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��MgCl2��Al2(SO4)3�Ļ����Һ�������в��ϼ���NaOH��Һ���õ��ij�����������NaOH��Һ�Ĺ�ϵ����ͼ��ʾ������Һ��c��Cl¯����c��SO42¯��֮��Ϊ�� ��
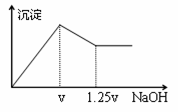
A��1��1 B��2��3 C��3��2 D��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NA��ʾ�����ӵ�����������˵������ȷ����
A. 1 mol FeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA
B.��״���£�5.6L�����к��й��ۼ�����ĿΪ2NA
C.16g�������ͳ�����ɵĻ�����к��еķ�������Ϊ0.5 NA
D. 0. 1 mol��ϩ���Ҵ��Ļ������ȫȼ�������ĵ���ԭ����һ��Ϊ0. 6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�صĻ���������࣬����Ҳ������ͬ��
(1)NO2�н�ǿ�������ԣ��ܽ�SO2��������SO3����������ԭΪNO����֪��������Ӧ�����������仯��ͼ��ʾ:
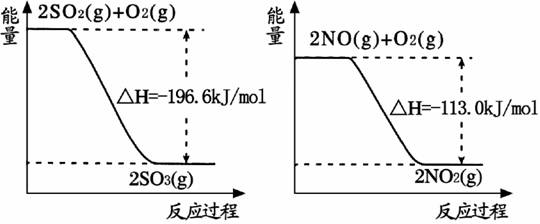 ��NO2����SO4���Ȼ�ѧ����ʽΪ ��
��NO2����SO4���Ȼ�ѧ����ʽΪ ��
(2)��2L�ܱ������з���1 mol��������һ���¶Ƚ������·�Ӧ:
2NH3(g)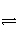
 N2(g)��3H2(g)����Ӧʱ��(t)��������������ѹǿ(p)���������±�
N2(g)��3H2(g)����Ӧʱ��(t)��������������ѹǿ(p)���������±�
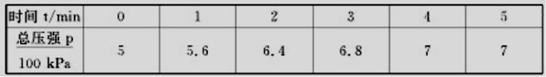
��ƽ��ʱ������ת����Ϊ ��
(3)�£�N2H4���ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ��ڿ�������ȫȼ�����ɵ���������Ӧת��0. 2 mol����ʱ�����������ڱ�״���µ����Ϊ ����������ˮ���Է����백ˮ���Ƶĵ��룬������ˮ��Һ�еĵ��뷽��ʽΪ ��дһ�����ɣ���
(4)NH4������Һ���ܷ���ˮ�ⷴӦ����25��ʱ��0. 1 mol/L�Ȼ����Һ��ˮ�������������Ũ��Ϊ1 X 10-5mol/L�����ڸ��¶��´���Һ�а�ˮ�ĵ���ƽ�ⳣ��Kb(NH3��H2O)= ��
(5)�����������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
�ٴ����������У�H2�ܽ�NO3-��ԭΪN3��25��ʱ����Ӧ����10 min����Һ��pH��7��Ϊ12������ƽ����Ӧ����v(NO3-)Ϊ ��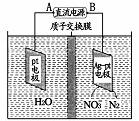
�ڵ绯ѧ����NO3-��ԭ������ͼ��ʾ������������ת����2 mol���ӣ���Ĥ������Һ�������仯��(��m��-��m�� )Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ��Cl�������ʵ���Ũ����50mL 1mol/L FeCl3��Һ��Cl�����ʵ���Ũ������ǣ�������
| �� | A�� | 100mL 1mol/L NaCl��Һ | B�� | 75mL 1mol/L MgCl2��Һ |
| �� | C�� | 150mL 3mol/L KCl��Һ | D�� | 25mL 2mol/L AlCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ȡ��ͬ������C6H6��C7H8��C6H12��C4H10����������ȫȼ��ʱ��O2�����
A��C6H6 B��C7H8 C��C6H12 D��C4H10
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com