
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
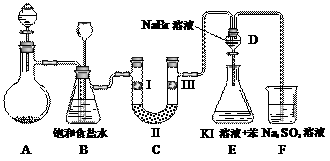
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
。
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为深棕红色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。该现象 (填“能”或“不能”)说明溴的非金属性强于碘,原因是 。
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
根据图回答下列问题:
 (1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:
____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol·L一CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO一+ H+,对于该平衡,下列叙述不正确的是 ( )
CH3COO一+ H+,对于该平衡,下列叙述不正确的是 ( )
A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大
B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大
C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol N2所含有的原子数为NA
B.标 准状况下,22.4 L水中含有的水分子数为NA
准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
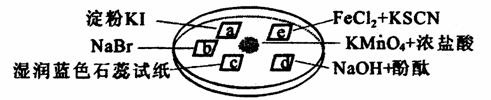
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2> |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色7 | 氯气与水生成了漂白性物质 |
| | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应3Cl2 + 8NH3 → 6NH4Cl + N2中,设阿伏加德罗常数为NA。则下列说法正确的是
A.若有0.3 mol Cl2参加反应,转移的电子数为0.6NA
B.若生成2.24 L氮气,转移的电子数为0.6NA
C.若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g
D.若生成1 mol的氯化铵转移电子数是n个,则NA=1/n
查看答案和解析>>
科目:高中化学 来源: 题型:
只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为0.1mol·L-1,)是
A.CaCl2和Na2CO3 B.稀盐酸和K2CO3 C.Ba(OH)2和NaHCO3 D.AgNO3和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为:N2+3H2  2NH3
2NH3
则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6 H2O (g)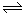 4NH3(g)+3O2(g) △H=Q ①
4NH3(g)+3O2(g) △H=Q ①
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3), 分别加 入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数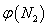 与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。

(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。
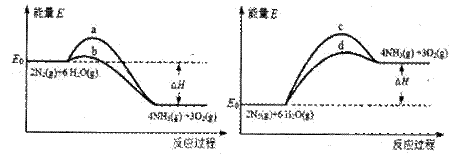
III.目前工业合成氨的原理是: N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol ②
2NH3(g) △H=-93.0kJ/mol ②
回答下列问题:
(1)结合II中的数据,则2H2(g)+ O2(g)=2 H2O (g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率
为 时,则起始时NH3的物质的量
时,则起始时NH3的物质的量 _________mol。
_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.化学是在分子、原子水平上认识物质,了解化学可以改变分子、创造出新的分子
B.医疗上所用“钡餐”使用的是氯化钡
C.氮化硅陶瓷、通讯光缆等都是新型无机非金属材料
D.盐卤能使蛋白质变性,因此喝不得,但可以用盐卤做豆腐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com