
NA表示阿伏加德罗常数,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.标准状况下,5.6L丙烷中含有共价键的数目为2NA
C.16g由氧气和臭氧组成的混合物中含有的分子总数为0.5 NA
D. 0. 1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0. 6NA
【知识点】阿伏伽德罗常数和物质的量、常用化学计量综合A1A4
【答案解析】D 解析:A、1 mol FeI2与足量氯气反应:3Cl2+2Fe2++4I-=2Fe3++6Cl-+2I2,转移3mol电子,电子数为3NA,故A错误; B、丙烷中共价键数为10个,5.6L物质的量为0.2mol,故共价键共2.5mol,个数2.5NA,故B错误;C、氧气和臭氧组成的混合物中含有的分子总数无法计算,故C错误;D、组成:乙烯C2H4和乙醇C2H6O可以写成:C2H4(H2O),完全燃烧所消耗的氧气=0.3mol,原子数=0.6mol,个数为0. 6NA,故D正确;
故答案选D
【思路点拨】本题考查化学计量综合应用,结合物质结构、氧化还原反应、有机物等知识,难度中等。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
下列各组离子能大量共存,且溶液为无色透明的是 ( )
A.Al3+、AlO2-、NO3-、Cl- B.CrO42-、H+、K+、NO3-
C.Ba2+、Na+、HCO3-、OH- D.K+、SO42-、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应3Cl2 + 8NH3 → 6NH4Cl + N2中,设阿伏加德罗常数为NA。则下列说法正确的是
A.若有0.3 mol Cl2参加反应,转移的电子数为0.6NA
B.若生成2.24 L氮气,转移的电子数为0.6NA
C.若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g
D.若生成1 mol的氯化铵转移电子数是n个,则NA=1/n
查看答案和解析>>
科目:高中化学 来源: 题型:
某碱金属R与其氧化物R2O的混合物2.16g,跟足量水充分反应后,将所得溶液蒸干,得固体3.2 g,由此判定金属是( )
A.锂 B.钠 C.钾 D.铷
查看答案和解析>>
科目:高中化学 来源: 题型:
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为:N2+3H2  2NH3
2NH3
则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6 H2O (g)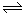 4NH3(g)+3O2(g) △H=Q ①
4NH3(g)+3O2(g) △H=Q ①
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3), 分别加 入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数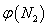 与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。

(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。
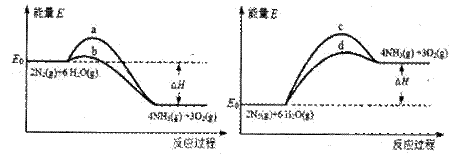
III.目前工业合成氨的原理是: N2(g)+3H2(g)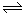 2NH3(g) △H=-93.0kJ/mol ②
2NH3(g) △H=-93.0kJ/mol ②
回答下列问题:
(1)结合II中的数据,则2H2(g)+ O2(g)=2 H2O (g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率
为 时,则起始时NH3的物质的量
时,则起始时NH3的物质的量 _________mol。
_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐x(仅含四种元素)的组成和性质.设
计并完成了如下实验:

另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答下列问题:
(1)X的化学式为 ,在隋性气流中加热X至完全分解的化学反应方程式为
。
(2)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 。并设计实验方案验证该反应的产物 。
(3)白色沉淀1中金属元素的原子结构示意图为 ,气体甲的电子式为 。
(4)自色沉淀2在空气中变成红褐色沉淀的原因是 。
(用化学反应方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用到玻璃棒:①过滤;②蒸发;③溶解;④向容量瓶里转移液体,其中玻璃棒的作用相同的是( )
A.①和② B.①和③ C.③和④ D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
有10g不纯净的碳酸钙(只含一种杂质),向其中加入过量的稀盐酸,充分反应并将所产生的CO2全部收集,体积为2.22L(标准状况),则这种杂质可能是( )
|
| A. | SiO2 | B. | MgCO3 | C. | NaHCO3 | D. | K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性大小:羧酸 > 碳酸 > 酚 > HCO3—。下列含溴化合物中的溴原子,在适当条件下都能被羟基(-OH)取代(均可称之为水解反应),所得产物能跟Na2CO3溶液反应的是
A. 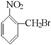 B.
B. 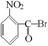 C.
C. 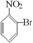 D.
D. 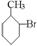
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com