
某研究小组为了探究一种无机矿物盐x(仅含四种元素)的组成和性质.设
计并完成了如下实验:

另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答下列问题:
(1)X的化学式为 ,在隋性气流中加热X至完全分解的化学反应方程式为
。
(2)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 。并设计实验方案验证该反应的产物 。
(3)白色沉淀1中金属元素的原子结构示意图为 ,气体甲的电子式为 。
(4)自色沉淀2在空气中变成红褐色沉淀的原因是 。
(用化学反应方程式表示)
【知识点】无极推断题C3 D3 D5
【答案解析】(1) CaFe(CO3)2 CaFe(CO3)2  CaO+FeO+2CO2↑
CaO+FeO+2CO2↑
(2)2FeO+CO2 Fe2O3+CO 检验方法:将固体用盐酸溶解,加入KSCN溶液,若溶液呈红色,证明有Fe(III);检测CO:将气体通入灼烧CuO,黑色固体变成红色。
Fe2O3+CO 检验方法:将固体用盐酸溶解,加入KSCN溶液,若溶液呈红色,证明有Fe(III);检测CO:将气体通入灼烧CuO,黑色固体变成红色。
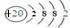
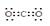
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
解析:气体甲能与溶液1先产生沉淀后沉淀溶解,则是二氧化碳与氢氧化钙的反应,说明固体X含有钙元素,隔绝空气加热产生气体二氧化碳,说明X含有碳、氧元素。同时根据溶液3先产生白色沉淀后产生红褐色,可得出固体1还含有铁元素
(1)X的化学式为:CaFe(CO3)2 在惰性气流中加热至完全分解的化学反应方程式为:
CaFe(CO3)2  CaO+FeO+2CO2↑
CaO+FeO+2CO2↑
(2)一定条件下,气体二氧化碳与固体1中的某种成分可能发生氧化还原反应,可能的化学反应方程式:2FeO+CO2 Fe2O3+CO 检验方法:将固体用盐酸溶解,加入KSCN溶液,若溶液呈红色,证明有Fe(III);检测CO:将气体通入灼烧CuO,黑色固体变成红色。(3)综上分析,白色沉淀1是碳酸钙,其中的金属元素是20号Ca,其原子结构示意图为:
Fe2O3+CO 检验方法:将固体用盐酸溶解,加入KSCN溶液,若溶液呈红色,证明有Fe(III);检测CO:将气体通入灼烧CuO,黑色固体变成红色。(3)综上分析,白色沉淀1是碳酸钙,其中的金属元素是20号Ca,其原子结构示意图为:
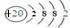 ;气体甲是CO2,其电子式为:
;气体甲是CO2,其电子式为: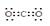 ;
;
(4)白色沉淀2在空气中变成红褐色沉淀的原因是4Fe(OH)2+O2+2H2O=4Fe(OH)3
【思路点拨】本题考查了物质的推断,注意寻找题目的突破口,大胆推测,题目有一定难度。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:

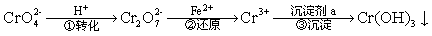
其中第①步中存在平衡:2CrO42-(黄色)+2H+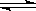 Cr2O72-(橙色)+H2O。下列有关说法正确的是 ( )
Cr2O72-(橙色)+H2O。下列有关说法正确的是 ( )
A.第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中
D.第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是( )
A.氢氧化镁中滴加盐酸:H++OH-=H2O
B.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+
C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH- NH3+CO32-+2H2O
NH3+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5
mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是( )
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.标准状况下,5.6L丙烷中含有共价键的数目为2NA
C.16g由氧气和臭氧组成的混合物中含有的分子总数为0.5 NA
D. 0. 1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0. 6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件略去):
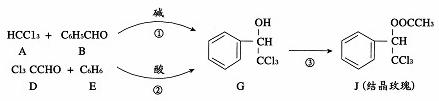
请回答下列问题.
(1)A的类别是__________,能与Cl2反应生成A的烷烃是__________;B中的官能团是__________。
(2)已知:B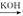 苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液、能除去的副产物是______________。
苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液、能除去的副产物是______________。
(3)已知: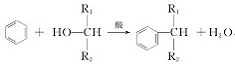 ,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为____________。
,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为____________。
(4 )G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生,且能发生消去反应,发生该消去反应需要的条件为__________,消去反应所得有机物的结构简式为____________(只写一种)。
(5)反应③的化学方程式为____________________。该反应的反应类型为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体物质,经测定其蒸气密度折合成标准状况约为1.518 g/L.该化合物可能是下列的( )
|
| A. | HCl | B. | H2S | C. | CH4 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1.84mol•L﹣1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有 100mL容量瓶、玻璃棒 填写名称).
(2)经计算,配制100mL 1.84mol•L﹣1的稀硫酸需要用量筒量取上述浓硫酸的体积为 10.0 mL.
(3)在烧杯中稀释浓硫酸的实验操作为 在小烧杯中加适量水,将浓硫酸缓慢加入水中,边加边搅拌
,若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为 先用干抹布抹去,再用较多的水冲洗,再用3%~5%的NaHCO3溶液冲洗 .
(4)对所配制的稀硫酸进行测定,发现其浓度大于1.84mol•L﹣1,配制过程中下列各项操作可能引起该偏差的是 ACE (填写字母)
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将硫酸稀释后立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,又补充几滴水至刻度处.

查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)分子中有18个氢原子的链烷烃的分子式: ▲
(2)2,3—二甲基—1—丁烯的结构简式: ▲
(3)用系统法命名: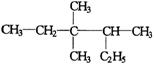
▲
 分子结构中有 ▲ 手性碳原子。
分子结构中有 ▲ 手性碳原子。
(4)CH2=CH—C≡CH结构中碳原子轨道的杂化方式是 ▲
(5)有机物的结构可用“键线式”简化表示。如CH3—CH=CH-CH3可简写为: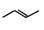 。
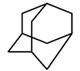
。
的分子式为 ▲ ,1mol该烃完全燃烧,需要标准状况下氧气
▲ 升;该烃的一溴取代物有 ▲ 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com