
下列实验操作均要用到玻璃棒:①过滤;②蒸发;③溶解;④向容量瓶里转移液体,其中玻璃棒的作用相同的是( )
A.①和② B.①和③ C.③和④ D.①和④
考点:
物质的分离、提纯的基本方法选择与应用..
专题:
化学实验常用仪器.
分析:
玻璃棒在很多操作中被用到,不同操作中玻璃棒的作用也不相同,如引流、搅拌加速溶解、防止液体飞溅、转移固体等作用.
在过滤操作中的作用是引流;
在蒸发操作和配制溶液中是搅拌;
蒸发完毕可以用玻璃棒转移固体;
玻璃棒还能起的作用是蘸取少许溶液测pH;
红磷燃烧试验中引燃红磷;
在溶解固体时是用玻璃棒来加速溶解,在过滤中用玻璃棒是引导液体的流向,防止外流,以此解答该题.
解答:
解:①过滤时用玻璃棒引流;②蒸发时用玻璃棒搅拌,防止局部过热;③溶解时用玻璃棒搅拌,可加速固体的溶解;④向容量瓶中转移液体,可用玻璃棒引流,
则玻璃棒作用相同的是①和④或②和③,
故选D.
点评:
本题主要考查了玻璃棒的作用,熟悉各实验中玻璃棒的作用及使用注意事项即可解答,学习中注意相关基础知识的积累,题目较简单.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.向体积为Va的0.02mol·L-1CH3COOH溶液中加入体积为Vb的0.02mol·L-1NaOH溶液,Va>Vb时:c (CH3COOH)+c(CH3COO-)>c (Na+)
B.将0.2 mol·L-1的盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-)
C.pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等
D.25℃时,pH=4,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解
成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3=5N2+6H2O;
②6NO2+8NH3=7N2+12H2O;③NO+NO2+2NH3=2N2+3H2O下列说法正确的是( )
A.NOx主要自于汽车尾气的排放,是引起温室效应的主要气体之一
B.N2中π键与σ键之比为12
C.反应③中每生成22.4LN2,转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.标准状况下,5.6L丙烷中含有共价键的数目为2NA
C.16g由氧气和臭氧组成的混合物中含有的分子总数为0.5 NA
D. 0. 1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0. 6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
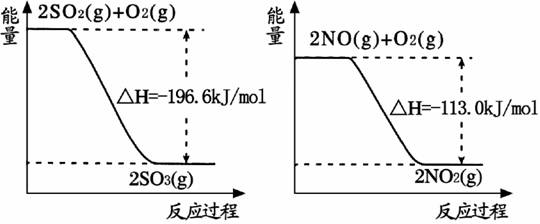 则NO2氧化SO4的热化学方程式为 。
则NO2氧化SO4的热化学方程式为 。
(2)在2L密闭容器中放入1 mol氨气,在一定温度进行如下反应:
2NH3(g)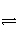
 N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
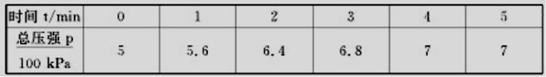
则平衡时氨气的转化率为 。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0. 2 mol电子时,生成气体在标准状况下的体积为 。联氨溶于水可以发生与氨水类似的电离,联氨在水溶液中的电离方程式为 (写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0. 1 mol/L氯化铵溶液由水电离出的氢离子浓度为1 X 10-5mol/L,则在该温度下此溶液中氨水的电离平衡常教Kb(NH3·H2O)= 。
(5)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,H2能将NO3-还原为N3,25℃时,反应进行10 min,溶液的pH由7变为12,则其平均反应速率v(NO3-)为 。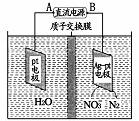
②电化学降解NO3-的原理如右图所示。若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右 )为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体物质,经测定其蒸气密度折合成标准状况约为1.518 g/L.该化合物可能是下列的( )
|
| A. | HCl | B. | H2S | C. | CH4 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与50mL 1mol/L FeCl3溶液中Cl﹣物质的量浓度相等是( )
|
| A. | 100mL 1mol/L NaCl溶液 | B. | 75mL 1mol/L MgCl2溶液 |
|
| C. | 150mL 3mol/L KCl溶液 | D. | 25mL 2mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.Na2O2 、HClO 、SO2等物质都具有漂白作用
B.液氨、液氯、液态氯化氢都是电解质
C.置换反应都是氧化还原反应,复分解反应都是非氧化还原反应
D.非金属氧化物不一定是酸性氧化物,某些金属氧化物也能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述正确的是:( )
A.某离子M层上和L层上的电子数均为K层的4倍
B.Cl-的结构示意图: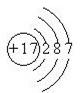
C.某物质的焰色反应为黄色,某物质一定为钠的化合物
D.14C和14N的质量数相等,互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com