
将标准状况下的a L氨气溶于1L水中,得到氨水的密度为b g•cm﹣3,则该氨水的物质的量浓度为( )
|
| A. |
| B. |
|
|
| C. |
| D. |
|
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中 Na2CO3质量分数的是
Na2CO3质量分数的是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过
质谱法测得为56,它的核磁共振氢谱显示只有两组峰;D可以发生银镜反应,在催化
剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个—CH3。
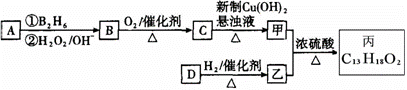

(1)A的结构简式为 ;乙的分子式为 。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是 ;D有多种同分异构体,其中与
其所含官能团相同的同分异构体有 种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为 。
(5)写出满足下列条件的有机物的结构简式
ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ苯环上有两个支链且苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
|
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于气体的性质和组成:
(1)22g CO2的物质的量为 0.5mol ,该气体在标准状况下的体积为 11.2L ,其中含有氧原子的数目为 6.02×1023 .
(2)等质量CO、CO2两种气体的摩尔质量之比为 7:11 ;同温同压下的体积比为 11:7 ;其中氧元素的原子个数比为 11:14 ;
(3)在标准状况下,某CO、CO2混合气体,其中CO、CO2质量比7:22,现有体积为20.16L的该混合气体,其中二氧化碳的物质的量为 0.6mol .
(4)已知4g RO32﹣中核外电子数比质子数多6.02×1022个,则元素R的相对原子质量为 32 .
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸。检验CuO经氢气还原所得到红色产物中是否含有碱性氧化物Cu2O的试剂是 ,反应的离子方程式 。
Ⅲ.实验室有黄铜(铜和锌两种金属的混合物)粉末。课外化学兴趣小组欲利用给出的实验仪器及试剂,测定该样品中锌的质量分数。除托盘天平必用外,供选择的实验装置如下图所示:
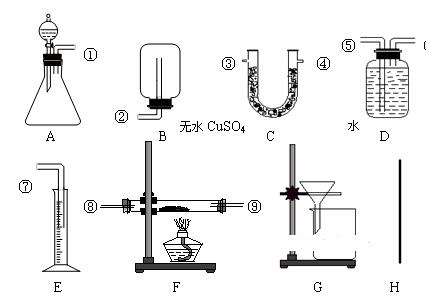
实验中可测得的数据:
黄铜的质量ag ; 充分反应后在标况下生成氢气的体积为bL
反应前仪器和药品的质量为c g ;充分反应后剩余固体的质量为d g
充分反应后仪器和药品的质量为e g
(1)实验中可供选择的药品除样品外,还有:①足量的浓硫酸、②足量的稀硫酸、③氧化铜。你认为一定要用到的药品是 (填序号)。
(2)甲同学实验中使用了A、D、E三种装置,组装时接口编号的连接顺序为 ,(填序号)写出合金中锌的质量分数的计算式 。
(3)乙同学实验中测得的数据为:黄铜的质量a g;充分反应后剩余固体的质量为d g。他在实验中使用了上图中 装置(填符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
若20g密度为dg/cm3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是( )
A.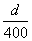 mol/L B.
mol/L B.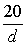 mol/L C.2.5d mol/L D.1.25d mol/L
mol/L C.2.5d mol/L D.1.25d mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com