
0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
|
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
A.H+、Ba2+、Mg2+、N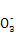 B.Cl-、C
B.Cl-、C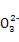 、Cu2+、Mg2+
、Cu2+、Mg2+
C.N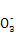 、S
、S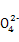 、K+、OH- D.N
、K+、OH- D.N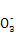 、HC
、HC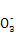 、Ba2+、Cl-
、Ba2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
毒豇豆、毒黄瓜等毒蔬菜中含有禁用农药水胺硫磷,水胺硫磷的结构简式如图所示,对该化合物的叙述正确的是( )
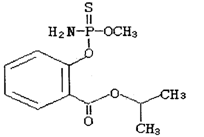
A.该化合物属于芳香烃
B.该化合物中至少有7个碳原子在同一平面
C.该化合物的分子式为C11H14O4NPS
D.该化合物能发生加聚反应、水解反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 =578kJ/mol,I2= 1817kJ/mol, I3= 2745kJ/mol,I4 =11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题。
(1)AY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在_________个σ键。
(2)X与NaOH溶液反应的离子方程式为___________。超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,晶体与金刚石类似,属于___________晶体.B的最简单氢化物容易液化,理由是___________。
(3)X、氧、B元素的电负性由大到小顺序为___________________(用元素符号作答)。
(4)Z的基态原子核外电子排布式为_____________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z十HCl十O2 = ZCI十HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是___________(填序号)。
①氧化剂是O2②HO2在碱中不能稳定存在③氧化产物是HO2, ④1 molZ参加反应有1 mol电子发生转移
已知Z的晶胞结构如下图所示,又知Z的密度为9.00g/cm3,则晶胞边长为______ ;ZYO4常作电镀液,其中YO42-的空间构型是____________ 。Y原子的杂化轨道类型是________。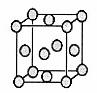
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 1mol H2O的质量为18g/mol |
|
| B. | CH4的摩尔质量为16g |
|
| C. | 3.01×1023个SO2分子的质量为32g |
|
| D. | 标准状况下,1mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的a L氨气溶于1L水中,得到氨水的密度为b g•cm﹣3,则该氨水的物质的量浓度为( )
|
| A. |
| B. |
|
|
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
取1.43g Na2CO3•10H2O溶于水配成100mL溶液,Na+ 物质的量浓度为 0.1mol/L ;取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)为 230mL .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.向海水中加碱、过滤、加酸,之后浓缩结晶、过滤、干燥、电解能得到金属镁
B.将淡黄色的过氧化钠粉末加入到石蕊试液中,石蕊试液先变红后褪色
C.合金性能一般优于纯金属,钢铁比纯铁具有更好的抗锈蚀能力
D.将碘水倒入分液漏斗,加适量乙醇振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在水溶液中的电离方程式书写正确的是( )
A.KClO3=K++3O2—+Cl5+ B.NaHSO4 = Na++HSO4—
C.H2SO4=H++ SO42— D.Al2(SO4)3 = 2Al3++3SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com