
下列条件下,两种气体所含的原子数一定相等的是( )
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO D.同压强、同体积的N2O和CO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(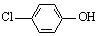 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
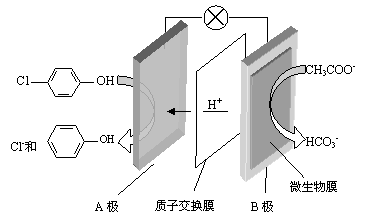
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
|
 |  | ||||
 |
 |
① 阳极的电极反应式为 。
② 简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
A.CaO+H2O==Ca(OH)2 B.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
C.CaCO3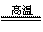 CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
关于用CCl4萃取碘水的说法中不正确的是( )
A.碘在CCl4中的溶解度大于在水中的溶解度 B.萃取后上层颜色变浅
C.萃取后CCl4溶液层为紫红色 D.用酒精也可萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
有一包白色固体粉末,可能含有CuSO4、Ba(NO3)2、Na2SO4、K2CO3、KCl中的一种或几种,按以下步骤进行实验:
①将该固体粉末溶于足量水中得无色溶液和白色沉淀 ②加入足量稀硝酸,沉淀部分溶解并有气体产生
根据以上实验现象推断:
(1)该白色粉末中一定含有 ;一定不含有 ;可能含有 (写化学式)
(2)生成白色沉淀的离子方程式为: 、
(3)沉淀加入稀硝酸反应的离子方程式为:
(4)要确定可能含有的物质,还需要进行的实验操作是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是 ( )
A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3- I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度 。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度 。
实验原理:
为了测定平衡时的c(I3-) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 = 2NaI + Na2S4O6。由于溶液中存在I3- I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1).用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2).将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3).分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4).带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因
是 。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是 。
③滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
④用c 、V1 和V2 表示c(I3-)为 mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,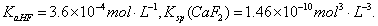 现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1mol·L-1HF 溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com