
分析 (1)根据n=$\frac{m}{M}$计算出水的物质的量,再根据总物质的量、氢原子守恒列式计算出乙炔和乙烷的物质的量;
(2)反应后CO和CO2的混合气体的物质的量为反应前氧气的4/5时,结合碳原子守恒可计算出b;然后结合碳原子守恒、H原子守恒可列式计算出二氧化碳、一氧化碳的物质的量,最后计算出二者的物质的量之比;
(3)混合烃燃烧生成n(H2O)=2mol,混合烃中总共含有4molH原子,由极端假设可得:当amol完全为乙炔时a有最大值,若燃烧完全生成二氧化碳,此时b有最大值;
当混合烃完全为乙烷时,此时a有最小值,若燃烧只生成CO时,耗氧量最少,据此进行计算.
解答 解:(1)n(H2O)=$\frac{36g}{18g/mol}$=2mol,含有4molH原子,当a=1时,设混合气体中含有xmol乙炔、ymol乙烷,
根据总物质的量可得:①x+y=1,根据H原子守恒可得:②2x+6y=4,
联立①②解得:x=y=0.5mol,
答:当a=1时,乙炔和乙烷的物质的量均为0.5mol;
(2)a=1时,1mol乙烷和乙炔的混合物中含有2molC原子,根据C原子守恒可得:$\frac{4}{5}$b=1mol×2,解得:b=2.5mol,
则:n(CO)+n(CO2)=2mol(C原子守恒)
n(CO)+2n(CO2)+n(H2O)=2.5mol×2(O原子守恒),
解得:n(CO)=1mol、n(CO2)=1 mo l,所以n(CO):n(CO2)=1:1,
答:b的值为2.5;生成CO和CO2的物质的量的比值为1:1;
(3)混合烃燃烧生成n(H2O)=2mol,混合烃中总共含有4molH原子,
由极端假设可得:当amol完全为乙炔时,乙炔的物质的量为:$\frac{4mol}{2}$=2mol,若燃烧完全生成二氧化碳,此时b有最大值:2.5×2mol=5mol;
当全为乙烷时,乙烷的物质的量为:$\frac{4mol}{6}$=$\frac{2}{3}$mol,若燃烧只生成CO时,耗氧量最少,则b的最小值为:$\frac{2}{3}$mol×$\frac{5}{2}$=$\frac{5}{3}$mol,
故a的范围为:$\frac{2}{3}$<a<2,b的范围为:$\frac{5}{3}$<b<5,
答:a的范围为:$\frac{2}{3}$<a<2,b的范围为:$\frac{5}{3}$<b<5.
点评 本题考查了有关范围讨论的计算,题目难度中等,明确发生反应的原理为解答根据,注意掌握质量守恒定律、极值讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸的产量是衡量一个国家石油化工水平发展的标志 | |
| B. | 石油裂化的主要目的是为了获得短链的不饱和烃 | |
| C. | 臭氧空洞的形成与化石燃料煤、石油的大量使用无关 | |
| D. | 石油的主要成分是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
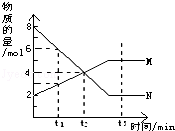
| A. | 反应的化学方程式为:2N?M | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t1时,N的浓度是M的浓度的3倍 | D. | t3时,正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲酸乙酯,可能有甲醇 | B. | 四种物质都有 | ||
| C. | 有甲酸乙酯和甲酸 | D. | 有甲醇和甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
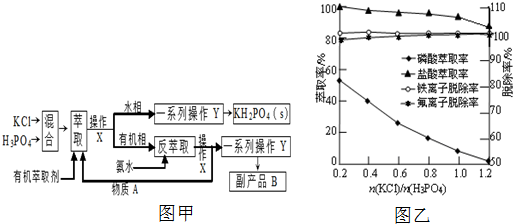
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
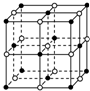 食盐晶体是由钠离子(图中的“
食盐晶体是由钠离子(图中的“ ”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )| A. | 3.0×10-8 cm | B. | 3.5×10-8 cm | C. | 4.0×10-8 cm | D. | 5.0×10-8 cm |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 降低温度 | B. | 增大容器体积 | C. | 升高温度 | D. | 选用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
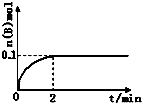
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com