
【题目】(1)写出下列反应的热化学方程式:
①.N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量: __________。
②1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ的热量:________ 。
(2)101 kPa条件下,氮气和氢气反应生成氨气的能量变化示意图如下:

已知:a=1127;b=1219,则:1molN2和3molH2参与反应生成2molNH3________(填“吸收”或“放出”)热量_____kJ。
【答案】N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol 放出 184
【解析】
(1)①N2和H2完全反应生成1molNH3放热46.1kJ热量,生成2mol氨气放热92.2kJ,据此书写热化学方程式;
②标注物质聚集状态和对应反应焓变写出热化学方程式;
(2)反应热=反应物中的键能之和与生成物中的键能之和的差,根据反应物和产物能量高低判断反应热的正负及反应过程的能量变化数值的多少。
(1)①N2和H2完全反应生成1molNH3放热46.1kJ热量,生成2mol氨气放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol;
②1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol;
(2)根据图示知道反应物的能量高于生成物的能量,所以该反应放热,反应热=反应物的键能-生成物的键能,氮气和氢气反应生成氨气的热化学方程式为:![]() N2(g)+
N2(g)+![]() H2(g)= NH3(g) △H=a-bkJ/mol,则N2(g)+ H2(g)=2NH3(g), △H=2(a-b)kJ/mol=2(1127-1219)kJ/mol=-184kJ/mol。即:1molN2和3molH2参与反应生成2molNH3气放出184kJ的热量。
H2(g)= NH3(g) △H=a-bkJ/mol,则N2(g)+ H2(g)=2NH3(g), △H=2(a-b)kJ/mol=2(1127-1219)kJ/mol=-184kJ/mol。即:1molN2和3molH2参与反应生成2molNH3气放出184kJ的热量。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、X B. X、Z、Q、G、Y
C. X、Z、Q、Y、G D. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.苯和甲苯都能使酸性KMnO4溶液褪色
B.饱和溴水滴入苯酚的稀溶液中,生成白色沉淀
C.乙醛与新制Cu(OH)2悬浊液共热能生成砖红色沉淀
D.乙酸能与NaHCO3溶液反应生成无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验安全下列说法正确的是
A.用排水法收集氧气时,先熄灭酒精灯,再把导气管从水槽中取出
B.在贴有此标志 的地方,禁止吸烟
的地方,禁止吸烟
C.浓硫酸不小心沾在皮肤,先用大量水冲洗,再涂上3﹪~5﹪的烧碱溶液
D.氢气点燃不会发生爆炸,所以在点燃前不需要验纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:mA(g)+nB(g)eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是
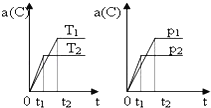
A.化学方程式中:m+n>e
B.达到平衡后,使用催化剂,C的体积分数将增大
C.达到平衡后,若温度升高,化学平衡向逆反应方向移动
D.达到平衡后,若增大体系的压强,化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备NaNO2,并探究其性质。
I.制备NaNO2
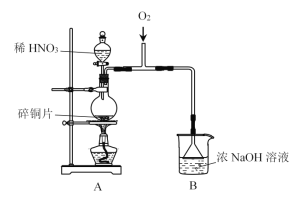
(1)A中发生反应的化学方程式是__________。
(2)B中选用漏斗替代长直导管的优点是________。
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2 mLB中溶液 | 加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2 mLB中溶液 | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2 mLH2O | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是________。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是_________。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)溶液迅速变为棕色的原因是_________。
(6)已知棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是_________。
(7)最终棕褐色溶液的成分是Fe(OH)x(SO4)y,测得装置中混合溶液体积为20 mL,设计如下实验测定其组成。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。
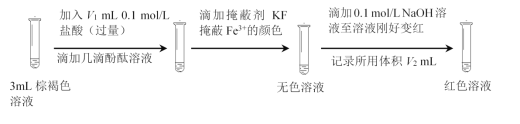
Fe(OH)x(SO4)y中x=_______(用含V1、V2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
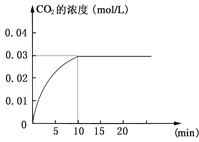
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=____________mol/L,该温度下的平衡常数K= (计算出结果)。
(2)判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的 CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿可以制成太阳能电池、发光二极管和催化剂,甚至可以制成未来量子计算机的元件。钙钛矿并不是专指某种含钙和钛的化合物,而是一类具有ABX3组成的晶体材料的总称,其中A和B是阳离子,X是阴离子。
(1)历史上所发现的第一种钙钛矿,是天然矿物钛酸钙(CaTiO3),其中Ti4 +的核外电子排布式为____;钛酸钙中两种阳离子中半径较大的是__。
(2)一种有机卤化铅钙钛矿是由[CH (NH2)2]+、Pb2+和Cl-构成的,这种钙钛矿的化学式为___,在[CH(NH2)2]+中碳原子的杂化方式为____。
(3)2018年我国科学家制得世界首例无金属钙钛矿材料。下列有机阳离子均可用于制备无金属钙钛矿:
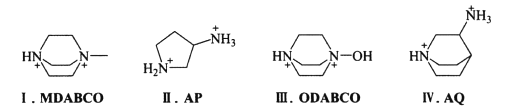
其中含有手性碳原子的是____(填序号)。
(4)如图是CaTiO3的两种晶胞结构示意图,两种晶胞的参数均为a=b=c=379. 5 pm,α=β=γ=90°;
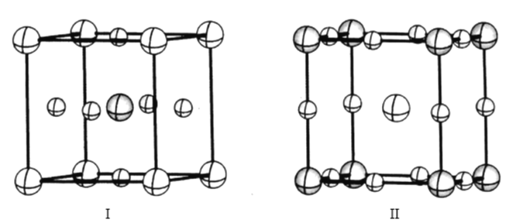
在晶胞I中氧离子占据的是___(填“体心”“面心”或“顶点”),在晶胞II中氧离子之间最近的距离是___pm(列出计算表达式)。
(5)无金属钙钛矿MDABCO—NH4 I3的晶胞类型与CaTiO3相同。若在MDABCO-NH4I3的晶胞中NH4+的分数坐标为(![]() ,
,![]() ,
,![]() ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0,![]() ),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
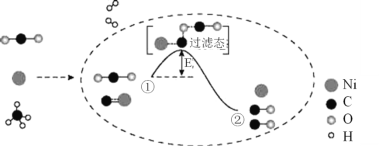
下列说法中不正确的是( )。
A.Ni是该反应的催化剂
B.过程①→②既有碳氧键的断裂,又有碳氧键的形成
C.过程①→②是吸热反应
D.反应的总化学方程式可表示为:CH4 +CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com