
【题目】可逆反应:mA(g)+nB(g)eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是
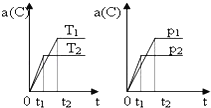
A.化学方程式中:m+n>e
B.达到平衡后,使用催化剂,C的体积分数将增大
C.达到平衡后,若温度升高,化学平衡向逆反应方向移动
D.达到平衡后,若增大体系的压强,化学平衡向正反应方向移动
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】一定量混合气体在密封容器中发生如下反应:xA(g)+yB(g)![]() nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
A.x+y<nB.该化学平衡向右移动
C.B的转化率增大D.A的物质的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。
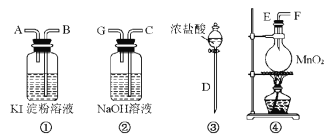
请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,______接_____,_____接____。
(2)圆底烧瓶中发生反应的化学方程式为____________。
(3)证明Cl2比I2的氧化性强的实验现象是_____________,反应的离子方程式是________。
(4)装置②的作用是___________。
(5)若要证明Cl2的氧化性比Br2强,则需做的改动是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,11.2L盐酸的原子总数为NA
B.常温常压下,14gN2含有的分子数为0.5NA
C.标准状况下,6.72L氖气中含有的分子数为0.3NA
D.常温常压下,9gH2O中含有的原子总数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的热化学方程式:
①.N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量: __________。
②1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ的热量:________ 。
(2)101 kPa条件下,氮气和氢气反应生成氨气的能量变化示意图如下:

已知:a=1127;b=1219,则:1molN2和3molH2参与反应生成2molNH3________(填“吸收”或“放出”)热量_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定的密闭容器中,发生可逆反应:M(g)+N(g)![]() 2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是________,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为从海带中提取碘,某研究性学习小组设计并进行以下实验:
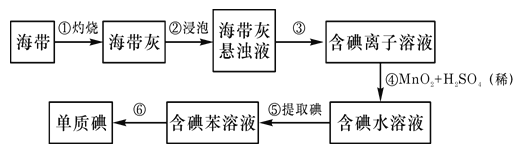
请填写下列空白:
(1)步骤③中过滤操作时,除需要铁架台、烧杯等,还需用到的玻璃仪器是___。
(2)步骤④中反应的离子方程式是___。
(3)步骤⑤和⑥的实验操作名称分别是___和____。
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:CCl4与碘单质不反应,___。
(5)酸性条件下,若用IO3-将I-氧化为I2,则I-和IO3-的物质的量之比为___。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为__________,说明固体中含有Mg3N2,生成该气体的化学反应方程式为_________________________。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是_____,对A加热的目的是______________________________________。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2 _______g(用含a的式子表示)。
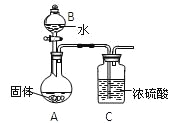
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是__________________________________________________________________________________________________。
有的同学认为乙组同学的测定结果偏低,理由是____________________________________________________________________________________________________________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并
灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是_______________________________________________________________________________________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为_____________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式__________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com