
【题目】镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为__________,说明固体中含有Mg3N2,生成该气体的化学反应方程式为_________________________。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是_____,对A加热的目的是______________________________________。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2 _______g(用含a的式子表示)。
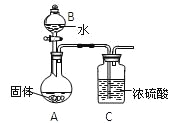
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是__________________________________________________________________________________________________。
有的同学认为乙组同学的测定结果偏低,理由是____________________________________________________________________________________________________________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并
灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是_______________________________________________________________________________________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为_____________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式__________________________________________________________________________________________。
【答案】NH3 Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑ 吸收生成的NH3 将装置A中反应产生的NH3全部驱赶到装置C中 ![]() C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高 可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低 向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次 10% (NH4)2SO4+MgO
C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高 可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低 向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次 10% (NH4)2SO4+MgO![]() MgSO4+2NH3↑+H2O
MgSO4+2NH3↑+H2O
【解析】
(1)能使湿润的红色石蕊试纸变蓝的气体是NH3,Mg3N2与水反应生成Mg(OH)2和NH3。
(2)浓硫酸是酸性干燥剂,可吸收NH3,对A加热可促使NH3挥发,使反应产生的NH3全部被C装置吸收,则由关系式Mg3N2~2NH3可求出a g NH3对应![]() g Mg3N2。
g Mg3N2。
(3)A装置中产生的NH3会含有水蒸气,C装置中浓H2SO4既吸收NH3,也吸收NH3中的水蒸气,而且C装置后未连接隔绝空气中水蒸气的装置,所以C装置增重的a g中包括水蒸气的质量,造成测定结果偏高。反应产生的NH3在反应结束后由于气压的原因无法全部被排出,而在装置中滞留一部分,造成产生的NH3不能全部被浓硫酸吸收,所以会造成测定结果偏低。
丙组同学所得4.08 g固体是MgO,包括原混合物中的MgO和Mg3N2转化来的MgO(Mg3N2~3Mg(OH)2~3MgO),
Mg3N2→ 3MgO △m(固体增重)
100g 120g 20g
m(Mg3N2) 0.08g
100g:20g= m(Mg3N2):0.08g,解得m(Mg3N2)=0.4g
故镁在空气中燃烧后生成的固体中Mg3N2的质量分数为![]() ×100% =10%。
×100% =10%。
(4)含镁矿石粉中含MgO,MgO与(NH4)2SO4高温反应生成MgSO4、NH3和H2O。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:mA(g)+nB(g)eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是
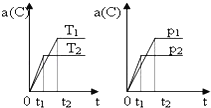
A.化学方程式中:m+n>e
B.达到平衡后,使用催化剂,C的体积分数将增大
C.达到平衡后,若温度升高,化学平衡向逆反应方向移动
D.达到平衡后,若增大体系的压强,化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
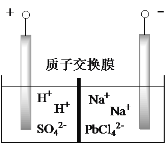
【题目】铅蓄电池是最常见的二次电池,以废旧铅蓄电池中的铅膏(主要含PbO、PbO2、PbSO4等)为原料回收铅,对保护环境和发展循环经济意义重大。某工艺流程如下:
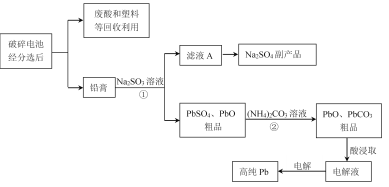
(1)已知铅蓄电池总反应:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,充电时,阳极的电极反应式为________。
2PbSO4+2H2O,充电时,阳极的电极反应式为________。
(2)过程①体现Na2SO3的_________性。
(3)由滤液A可获得Na2SO4·10H2O粗品,检验粗品中SO42-离子的实验方法是________。
(4)结合化学用语解释过程②中PbSO4转化为PbCO3的原因________。
(5)反应温度对过程②转化率(脱硫率)的影响如图所示,实际生产中温度选择在50℃,若温度过高,脱硫率下降的原因可能是:________。
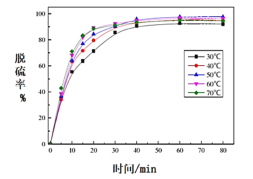
(6)将PbO 、PbCO3粗品置于一定浓度HCl和NaCl浸取液中溶解,得到含Na2PbCl4的电解液,如图电解可得高纯Pb,同时再生浸取液。请结合化学用语解释浸取液再生的原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是()
①过氧化钠加入水中:![]()
②用小苏打治疗胃酸过多:![]()
③实验室用石灰石和盐酸反应制取![]() :
:![]()
④![]() 与
与![]() 反应:
反应:![]()
⑤氯化铁溶液中加铁粉![]()
⑥将过量的![]() 通入NaOH溶液中
通入NaOH溶液中 ![]()
A.①③④⑥B.②⑤C.①②③④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
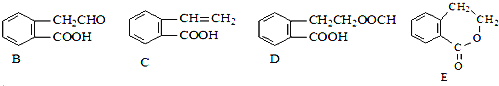
请回答下列问题:
![]() 在
在![]() 五种物质中,互为同分异构体的是______
五种物质中,互为同分异构体的是______![]() 填代号
填代号![]() 。
。
![]() 写出下列反应的反应类型
写出下列反应的反应类型![]() :______,
:______,![]() :______,
:______,![]() :______,
:______,![]() :______。
:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
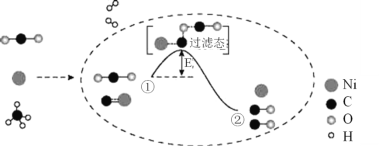
下列说法中不正确的是( )。
A.Ni是该反应的催化剂
B.过程①→②既有碳氧键的断裂,又有碳氧键的形成
C.过程①→②是吸热反应
D.反应的总化学方程式可表示为:CH4 +CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
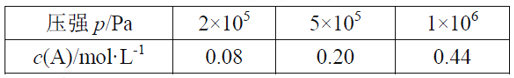
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为N![]() ,关于反应
,关于反应 下列说法错误的是
下列说法错误的是
A.8.8gCO2中共用电子对的数目为0.8NA
B.消耗CO24.48L(标准状况下)时转移电子的数目为0.8NA
C.12g金刚石(C)中所含共价键的数目为4NA
D.0.1molMgO中所有离子的最外层电子数之和为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com