
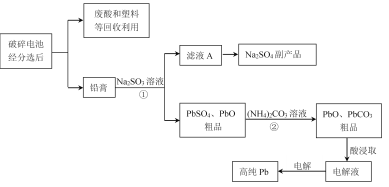
【题目】铅蓄电池是最常见的二次电池,以废旧铅蓄电池中的铅膏(主要含PbO、PbO2、PbSO4等)为原料回收铅,对保护环境和发展循环经济意义重大。某工艺流程如下:
(1)已知铅蓄电池总反应:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,充电时,阳极的电极反应式为________。
2PbSO4+2H2O,充电时,阳极的电极反应式为________。
(2)过程①体现Na2SO3的_________性。
(3)由滤液A可获得Na2SO4·10H2O粗品,检验粗品中SO42-离子的实验方法是________。
(4)结合化学用语解释过程②中PbSO4转化为PbCO3的原因________。
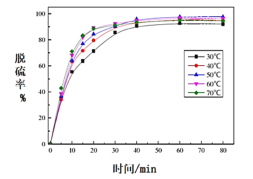
(5)反应温度对过程②转化率(脱硫率)的影响如图所示,实际生产中温度选择在50℃,若温度过高,脱硫率下降的原因可能是:________。
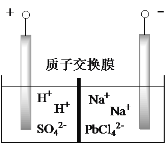
(6)将PbO 、PbCO3粗品置于一定浓度HCl和NaCl浸取液中溶解,得到含Na2PbCl4的电解液,如图电解可得高纯Pb,同时再生浸取液。请结合化学用语解释浸取液再生的原理________。
【答案】PbSO4-2e-+2H2O=PbO2+4H++SO42- 还原 取少量晶体,加足量盐酸,再滴加BaCl2溶液,若产生白色沉淀,则阴离子为SO42- PbSO4 +CO32﹣=PbCO3+SO42- 温度过高,碳酸铵分解 阴极PbCl42-+2e-=Pb+4Cl-,H+离子在电压作用下穿过质子交换膜向阴极室定向移动,形成HCl和NaCl混合液
【解析】
以废旧铅蓄电池分选处理得到铅膏(主要含PbO、PbO2、PbSO4等),向铅膏中加入足量Na2SO3溶液,PbO、PbSO4与Na2SO3溶液不反应,PbO2具有氧化性,与Na2SO3溶液发生氧化还原反应生成Na2SO4和PbO,过滤得到主要含有Na2SO4的滤液A,对滤液A蒸干得到副产品Na2SO4;过滤后的滤渣主要为PbO、PbSO4的粗品,向粗品中加入(NH4)2CO3,将PbSO4转化为更难溶的PbCO3,过滤洗涤得到PbO、PbCO3的粗品,加酸溶解浸取,得到含有Pb2+的电解质溶液,对溶液进行电解最终得到高纯Pb,据此分析解答。
(1)根据铅蓄电池总反应:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O可知,充电时,阳极上PbSO4失去电子,发生氧化反应,电极反应式为PbSO4-2e-+2H2O=PbO2+4H++SO42-;
2PbSO4+2H2O可知,充电时,阳极上PbSO4失去电子,发生氧化反应,电极反应式为PbSO4-2e-+2H2O=PbO2+4H++SO42-;
(2)根据分析,过程①为PbO2与Na2SO3溶液发生氧化还原反应生成Na2SO4和PbO,反应中S元素化合价升高,被氧化,则体现了Na2SO3的还原性;
(3)由滤液A可获得Na2SO4·10H2O粗品,检验粗品中SO42-离子的实验方法是取少量晶体,加足量盐酸,再滴加BaCl2溶液,若产生白色沉淀,则阴离子为SO42-;
(4)过程②中由于碳酸铅的溶解度比硫酸铅的溶解度小,较难溶的沉淀会转化为更难溶的沉淀,即发生沉淀的转化,则PbSO4转化为PbCO3,发生的离子反应为PbSO4+CO32﹣=PbCO3+SO42-;
(5)过程②转化率(脱硫率)是利用碳酸铵与硫酸铅反应转化为可溶性的硫酸根离子将硫除去,铵盐的稳定性较差,温度过高会发生分解,高温下,碳酸铵受热分解生产二氧化碳和氨气从溶液中逸出,导致溶液中碳酸根离子浓度减小,硫酸铅不能全部转化为碳酸铅,沉淀的转化量较少,脱硫率降低;
(6)将PbO、PbCO3粗品置于一定浓度HCl和NaCl浸取液中溶解,得到含Na2PbCl4的电解液,根据电解装置图所示,与电源负极相连的为电解池的阴极,阴极上PbCl42-+2e-=Pb+4Cl-,H+离子在电压作用下穿过质子交换膜向阴极室定向移动,形成HCl和NaCl混合液,从而使浸取液再生。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定的密闭容器中,发生可逆反应:M(g)+N(g)![]() 2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是________,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为从海带中提取碘,某研究性学习小组设计并进行以下实验:
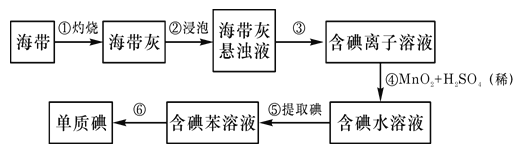
请填写下列空白:
(1)步骤③中过滤操作时,除需要铁架台、烧杯等,还需用到的玻璃仪器是___。
(2)步骤④中反应的离子方程式是___。
(3)步骤⑤和⑥的实验操作名称分别是___和____。
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:CCl4与碘单质不反应,___。
(5)酸性条件下,若用IO3-将I-氧化为I2,则I-和IO3-的物质的量之比为___。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。该电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
A.放电时,正极反应为Cd-2e-+2OH-=Cd(OH)2
B.充电时,阳极区附近溶液的pH不断变小
C.放电时,每转移0.2mol电子,有0.1mol负极材料被还原
D.充电时,阴极反应为2NiOOH-2e-+2OH-=2Ni(OH)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是
A.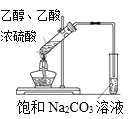 实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.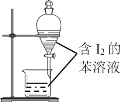 苯萃取碘水中I2,分出水层后的操作
苯萃取碘水中I2,分出水层后的操作
C. 检验CH3CH2Br消去反应的产物乙烯
检验CH3CH2Br消去反应的产物乙烯
D.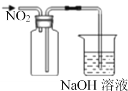 收集NO2气体
收集NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图装置进行铜与浓硫酸反应时,发现试管中有黑色物质产生。同学猜测,黑色物质中可能含有CuO、Cu2S和CuS,针对产生的黑色物质,该小组同学继续进行实验探究,获得数据如表。下列说法不正确的是
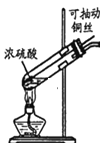
硫酸浓度/ mol·L﹣1 | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
A.硫酸浓度越大,黑色物质越易出现、越难消失
B.黑色物质消失过程中有SO2、H2S生成
C.硫酸浓度为16 mol·L﹣1时,先升温至250℃以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质
D.取黑色物质洗涤、干燥后,加稀硫酸充分混合,固体质量不变,说明黑色物质中不含CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为__________,说明固体中含有Mg3N2,生成该气体的化学反应方程式为_________________________。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是_____,对A加热的目的是______________________________________。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2 _______g(用含a的式子表示)。
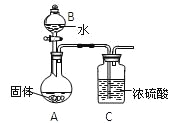
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是__________________________________________________________________________________________________。
有的同学认为乙组同学的测定结果偏低,理由是____________________________________________________________________________________________________________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并
灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是_______________________________________________________________________________________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为_____________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式__________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是
N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是

A.反应速率:v正(b点)<v正(d点)
B.前10min内用v(N2O4)表示的平均反应速率为0.04mol/(L·min)
C.25min时,导致平衡移动的原因是升高温度
D.a和c点:Qc(浓度熵)<K(平衡常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com