
【题目】下列实验操作或装置能达到目的的是
A.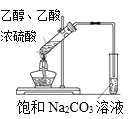 实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.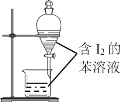 苯萃取碘水中I2,分出水层后的操作
苯萃取碘水中I2,分出水层后的操作
C. 检验CH3CH2Br消去反应的产物乙烯
检验CH3CH2Br消去反应的产物乙烯
D.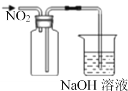 收集NO2气体
收集NO2气体
【答案】A
【解析】
A.乙醇和乙酸在浓硫酸作催化剂的条件下加热反应生成乙酸乙酯,用饱和碳酸钠溶液溶解乙醇,消耗乙酸,降低乙酸乙酯的溶解度,实验操作或装置均能达到目的,故A正确;
B.苯萃取碘水中I2,碘在苯中的溶解度大于在水中的溶解度,苯的密度比水小,碘的苯溶液在上层,上层液体从上层倒出,下层液体为水,从下层流出,实验操作不能达到目的,故B错误;
C.CH3CH2Br消去反应条件是氢氧化钠乙醇溶液,乙醇也可以使酸性高锰酸钾褪色,CH3CH2Br消去反应生成乙烯,乙烯有还原性,能使KMnO4溶液褪色,故应在酸性高锰酸钾溶液前加入蒸馏水,除去乙醇,故C错误;
D.二氧化氮的密度大于空气,若用D装置集气瓶短进长出收集二氧化氮,会使二氧化氮气体逸出,收集不到,应该采用长进短出,故D错误;
答案选A。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.苯和甲苯都能使酸性KMnO4溶液褪色
B.饱和溴水滴入苯酚的稀溶液中,生成白色沉淀
C.乙醛与新制Cu(OH)2悬浊液共热能生成砖红色沉淀
D.乙酸能与NaHCO3溶液反应生成无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
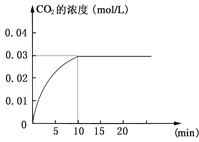
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=____________mol/L,该温度下的平衡常数K= (计算出结果)。
(2)判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的 CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿可以制成太阳能电池、发光二极管和催化剂,甚至可以制成未来量子计算机的元件。钙钛矿并不是专指某种含钙和钛的化合物,而是一类具有ABX3组成的晶体材料的总称,其中A和B是阳离子,X是阴离子。
(1)历史上所发现的第一种钙钛矿,是天然矿物钛酸钙(CaTiO3),其中Ti4 +的核外电子排布式为____;钛酸钙中两种阳离子中半径较大的是__。
(2)一种有机卤化铅钙钛矿是由[CH (NH2)2]+、Pb2+和Cl-构成的,这种钙钛矿的化学式为___,在[CH(NH2)2]+中碳原子的杂化方式为____。
(3)2018年我国科学家制得世界首例无金属钙钛矿材料。下列有机阳离子均可用于制备无金属钙钛矿:
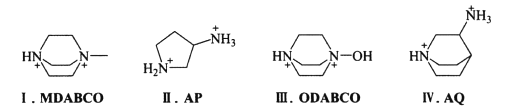
其中含有手性碳原子的是____(填序号)。
(4)如图是CaTiO3的两种晶胞结构示意图,两种晶胞的参数均为a=b=c=379. 5 pm,α=β=γ=90°;
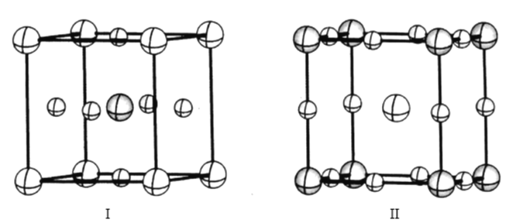
在晶胞I中氧离子占据的是___(填“体心”“面心”或“顶点”),在晶胞II中氧离子之间最近的距离是___pm(列出计算表达式)。
(5)无金属钙钛矿MDABCO—NH4 I3的晶胞类型与CaTiO3相同。若在MDABCO-NH4I3的晶胞中NH4+的分数坐标为(![]() ,
,![]() ,
,![]() ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0,![]() ),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
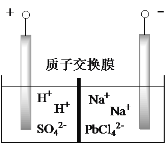
【题目】铅蓄电池是最常见的二次电池,以废旧铅蓄电池中的铅膏(主要含PbO、PbO2、PbSO4等)为原料回收铅,对保护环境和发展循环经济意义重大。某工艺流程如下:
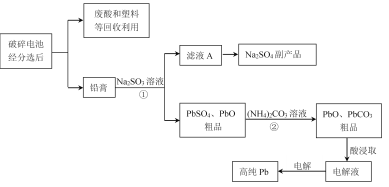
(1)已知铅蓄电池总反应:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,充电时,阳极的电极反应式为________。
2PbSO4+2H2O,充电时,阳极的电极反应式为________。
(2)过程①体现Na2SO3的_________性。
(3)由滤液A可获得Na2SO4·10H2O粗品,检验粗品中SO42-离子的实验方法是________。
(4)结合化学用语解释过程②中PbSO4转化为PbCO3的原因________。
(5)反应温度对过程②转化率(脱硫率)的影响如图所示,实际生产中温度选择在50℃,若温度过高,脱硫率下降的原因可能是:________。
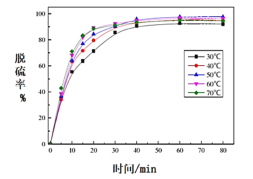
(6)将PbO 、PbCO3粗品置于一定浓度HCl和NaCl浸取液中溶解,得到含Na2PbCl4的电解液,如图电解可得高纯Pb,同时再生浸取液。请结合化学用语解释浸取液再生的原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是()
①过氧化钠加入水中:![]()
②用小苏打治疗胃酸过多:![]()
③实验室用石灰石和盐酸反应制取![]() :
:![]()
④![]() 与
与![]() 反应:
反应:![]()
⑤氯化铁溶液中加铁粉![]()
⑥将过量的![]() 通入NaOH溶液中
通入NaOH溶液中 ![]()
A.①③④⑥B.②⑤C.①②③④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
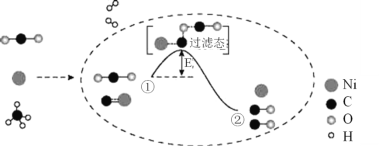
下列说法中不正确的是( )。
A.Ni是该反应的催化剂
B.过程①→②既有碳氧键的断裂,又有碳氧键的形成
C.过程①→②是吸热反应
D.反应的总化学方程式可表示为:CH4 +CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于煤、石油和天然气为原料的化工生产中,不经处理直接排放会引起大气污染,石油化工中产生的羰基硫可通过以下方法脱除。
Ⅰ.干法脱除:在催化剂存在下,COS和H2可发生两个平行反应:
i. COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=-17kJ/mol
H2S(g)+CO(g)△H1=-17kJ/mol
ii. COS(g)+4H2(g)![]() H2S(g)+CH4(g)+H2O(g) △H2
H2S(g)+CH4(g)+H2O(g) △H2
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
(2)T1℃时,向10L恒容密闭容器中充人1molCOS和4molH2,发生反应i和ii。5min时达到平衡,测得体系压强减少了20%,CO的体积分数为10%且其平衡分压为P1。
①0-5min内,v(COS)=______________。
②反应i的平衡常数K=______________。
③若在起始温度为T1℃的绝热容器中重复上述实验,H2的平衡分压P2______________P1(填“>”“=”或“<”),理由为______________。
Ⅱ.湿法脱除:原理为COS+4OH-=S2-+CO32-+2H2O。温度为293K时,将COS以固定流速匀速通入一定浓度的NaOH溶液中,测得体系内c(S2-)随时间(t)的变化如图所示:
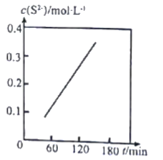
(3)由图可知,增大NaOH溶液的初始浓度,COS的吸收速率______________(填“增大”“减小”或“不变”),判断依据为______________。
(4)在上述反应体系中同时加入少量溴水,也能吸收COS并得到澄清溶液,发生反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com