
����˵����ȷ���� (����)��
| A����ӦA(g)??2B(g)����H��������Ӧ�Ļ��ΪEa kJ��mol��1���淴Ӧ�Ļ��ΪEb kJ��mol��1����H��(Ea��Eb)kJ��mol��1 |
| B����״���£���0.1 mol��L��1�İ�ˮ�м��������Ȼ�茶��壬�������ҺpH��7����c(NH4+)��c(Cl��) |
| C��������пͭ�Ͻ���100 mL pH��1ϡ���ᷴӦ����Ӧ3 sʱ���pH��2�����跴Ӧǰ����Һ��������ֲ��䣬��3 s�ڲ���������ƽ��������33.6 mL��s��1 |
D����Ũ��Ϊ0.1 mol��L��1 HF��Һ��ˮ����ϡ�����У�����ƽ�ⳣ��Ka(HF)���ֲ��䣬 ʼ�ձ������� ʼ�ձ������� |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������һ����ȷ����
| A���κ�Ũ����Һ������Զ�����pH��ֽ�ⶨ |
| B��ij�¶��£�pH=6.2�Ĵ�ˮ������ |
| C��25��ʱ��pH=1�Ĵ�����Һ��c(H+)��pH=2��������Һ��c(H+)��10�� |
| D��25��ʱ��pH=12��NaOH��Һ�е�n(OH��)=10-2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���100 mL ��0��02 mol��L��1��Ba(OH)2��Һ��100 mL ��0��02 mol��L��1��NaHSO4
��Һ��ϣ���������Һ����仯�����Ϻ����Һ
| A��pH��2 |
| B��pH��12 |
| C����ˮ���������c(H��)��1��0��10��2 mol��L��1 |
| D�����ʵ����ʵ���Ũ��Ϊ0��02 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪ij�¶�ʱCH3COOH�ĵ���ƽ�ⳣ��ΪK�����¶�����20 mL 0.1 mol/L CH3COOH��Һ��
��μ���0.1 mol/L NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)������˵������ȷ����
| A��a���ʾ��Һ��c(CH3COO��)ԼΪ10-3 mol/L |
| B��b���ʾ����Һ��c(Na��)��c(CH3COO��) |
| C��c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ |
D��d���ʾ����Һ�� ����K ����K |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25 ��ʱ,Ũ�Ⱦ�Ϊ0.2 mol/L��NaHCO3��Na2CO3��Һ��,�����жϲ���ȷ����(�� ��)
| A�������ڵ���ƽ���ˮ��ƽ�� |
| B�����ڵ�����������ͬ |
| C��c(OH-)ǰ�ߴ��ں��� |
D���ֱ����NaOH����,�ָ���ԭ�¶�,c(C )������ )������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����(����)��
A��0.1 mol��L��1�Ĵ�����Һ��ˮϡ�ͣ� ��С ��С |
| B�������pH����ͬ�Ĵ����������ȫ�ܽ������þ��(����)��������ʱ�� |
| C����ˮ�м������������������ƣ�c(H��)����KW��� |
| D�������£�V1 L pH��11��NaOH��Һ��V2 L pH��3��HA��Һ��ϣ������Һ�����ԣ���V1��V2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25 ��ʱ����Ũ��Ϊ0.100 0 mol��L��1��NaOH��Һ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.100 0 mol��L��1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵����ȷ����(����)��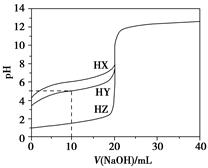
| A������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��HZ��HY��HX |
| B�����ݵζ����ߣ��ɵ�Ka(HY)��10��5 |
| C��������HX��HY��Һ�������Ϻ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ��c(X��)��c(Y��)��c(OH��)��c(H��) |
D��HY��HZ��ϣ��ﵽƽ��ʱc(H��)�� ��c(Z��)��c(OH��) ��c(Z��)��c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ����CH3COOH��Һ����NaOH��Һ����CH3COONa��Һ������˵������ȷ����( )
| A����Һ��pH����>��>�� |
| B��ˮ�������c(OH-)����>��>�� |
| C���ں͢۵������Ϻ����Һ��c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D���ٺ͢ڵ������Ϻ����Һ��c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й�˵������ȷ����(����)
| A��������,��1 L pH=12�İ�ˮ��ˮϡ��Ϊ10 L����Һ��pH=11 |
| B���мס�����������Һ,��ü�pH=a,�ҵ�pH=a+1,�������к͵����ʵ���Ũ�ȵ������NaOH��Һ,��ס�����������V (��)>10V(��) |
C����Ũ�Ⱦ�Ϊ0.1 mol��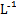 ��MgCl2��CuCl2�����Һ����μ��백ˮ,��������ɫ����,˵��Ksp[Cu(OH)2]>Ksp[Mg(OH)2] ��MgCl2��CuCl2�����Һ����μ��백ˮ,��������ɫ����,˵��Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D��ˮ�����ӻ�����KW�����¶ȵ����߶�����,˵��ˮ�ĵ����Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com