


科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.
甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
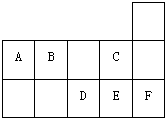
| A、A、B、D、E四种元素所形成的最高价含氧酸中D酸性最强 |
| B、形成的简单阴离子半径:C>B>D>E |
| C、D、E、F形成的单质都是双原子分子 |
| D、A与E形成的分子是一种常见有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
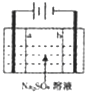 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ⅰ中碘为气态,ⅱ中碘为固态 |
| B、反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
| C、1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ |
| D、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应属于置换反应 |
| B、反应中I-离子发生还原反应 |
| C、Cl2的氧化性比I2的氧化性强 |
| D、生成1mol I2转移2mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com