
【题目】将Na2O2与过量NaHCO3混合固体在密闭容器中充分加热反应后,排出气体后最终剩余固体是( )
A.NaOH和Na2O2B.NaOH和Na2CO3
C.Na2CO3D.Na2O2
科目:高中化学 来源: 题型:
【题目】如图表示配制一定物质的量浓度溶液的几个关键实验步骤和操作,现欲配制250mL 0.100molL﹣1 Na2CO3溶液,回答下列问题: 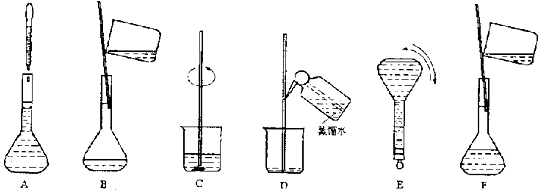
(1)将上述实验步骤A﹣F按实验过程先后次序排列 .
(2)步骤B通常称为转移,玻璃棒的作用是;步骤A通常称为 , 此时应注意与相切,如果俯视刻度线,配制的浓度(填偏大、偏小或无影响);步骤结束后发现液面低于刻度线,则配制的浓度(填偏大、偏小或无影响).
(3)下列关于容量瓶使用的说法正确的是
A.使用前须干燥
B.使用前先检查瓶塞不漏水
C.配好的溶液可以贮存在容量瓶中
D.热溶液须冷却至室温才能转移入容量瓶
E.容量瓶用于准确配制任意体积的一定物质的量浓度的溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是____________________,弊是________________________。聚合硫酸铁溶液中SO42与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42与Fe3+物质的量之比。
(4)测定时所需的试剂____________。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定____________和____________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作____________(按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则M离子可能为( )
所含离子 | NO3- | SO42- | H+ | M |
浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
A. Cl-B. Ba2+C. Na+D. Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( ) 
A.a点对应的溶液中:Na+、OH﹣、SO42﹣、NO3﹣
B.b点对应的溶液中:Al3+、Fe3+、SCN﹣、Cl﹣
C.c点对应的溶液中:Na+、Ca2+、NO3﹣、Cl﹣
D.d点对应的溶液中:SO32﹣、Na+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 图中:
①为氯气发生装置;
②的试管里盛有15mL30%NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过(仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式为; 实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL12molL﹣1的浓盐酸混合加热,充分反应后生成的氯气0.06mol.(填“大于”“小于”或“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的物质的量为 .
(3)写出装置②中发生反应的化学方程式 .
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
实验现象 | 原因 |
溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | |
然后溶液从无色逐渐变为色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com